

Vol. 38 (Nº 54) Ano 2017. Pág. 4
Helaine Cristine Gonçalves PIRES 1; Osmar Alves LAMEIRA 2; Alessandra Keiko Nakasone ISHIDA 3; Clenilda Tolentino Bento da SILVA 4; Alessandra de Nazaré Reis FREIRE 5; Ana Paula Ribeiro MEDEIROS 6
Recebido: 09/07/2017 • Aprovado: 05/08/2017
RESUMO: Objetivou-se avaliar o efeito de diferentes concentrações da óleoresina de Copaifera reticula na inibição do crescimento micelial in vitro de Fusarium oxysporum f. sp. passiflorae, Fusarium solani e Rhizoctonia solani. A pesquisa envolveu os fitopatógenos e as concentrações da óleoresina em esquema fatorial com 5 repetições. Os resultados demonstraram a eficiência da óleoresina na inibição do crescimento micelial in vitro em até 73,70% dos fitopatógenos. |
ABSTRACT: The objective of this study was to evaluate the effect of different concentrations of the Copaifera reticulata oleoresin in the inhibition of in vitro micelial growth of Fusarium oxysporum f. sp. passiflorae, Fusarium solani and Rhizoctonia solani. The research involved plant pathogens and oleoresin concentrations in a factorial scheme with 5 replicates. The results demonstrated the efficiency of the oleoresin in the inhibition of in vitro micelial growth in up to 73.70% of plant pathogens. |
As plantas medicinais em sua composição química apresentam substâncias chamadas de metabólitos secundários, as quais podem estar presentes nas interações entre espécie vegetal e o patógeno, como ativadores do sistema de defesa da planta hospedeira ou diretamente contra os fitopatógenos. Diversos trabalhos descrevem os sesquiterpenos (α-
humuleno, α- e β-selineno, β- bisaboleno e β-cariofileno), onde β-bisaboleno é constituído de propriedades anti-inflamatória e analgésica enquanto o β-cariofileno é antiedêmico, antiflamatório, antibactericida e antifúngico (VEIGA JÚNIOR e PINTO, 2002) e os diterpenos, ambos, extraídos de óleos, como metabólitos secundários que possuem atividade fungitóxica existente (OLIVEIRA et al, 2006). Algumas substâncias que compõem os óleos essenciais sintetizadas de plantas medicinais são utilizadas em seres humanos por conter propriedades antimicrobianas (SILVA et al, 1995).
A importância da espécie Copaifera reticulata Ducke é devido à produção de boa qualidade do óleo resina, utilizado pelas populações tradicionais e indústrias farmacêuticas em razão de suas propriedades terapêuticas. O óleo pode ser usado puro, in natura ou destilado, ou como componente na preparação de uma variedade de produtos terapêuticos e cosméticos (RIGAMONTE-AZEVEDO et al, 2006). O óleo natural de copaíba tem certa variedade em seus componentes, que o torna mais sensível aos fatores abióticos (insetos e fungos) do que a luminosidade e nutrientes (OLIVEIRA et al, 2006a).
O gênero Fusarium abrange espécies que formam um complexo de fungos de solo, as quais são agentes etiológicos de muitas doenças de importância econômica em plantas cultivadas, destacando-se as fusarioses do maracujazeiro causadas por Fusarium oxysporum Schelecht. f. sp. passiflorae Purss. e Fusarium solani (Mart.) Sacc. (COSTA et al., 2008; DARIVA, 2011). F. oxysporum f. sp. passiflorae é responsável pela murcha do maracujazeiro enquanto F. solani causa a podridão de colo, onde a infecção inicia-se pela raiz principal e evolui para o colo, ou vice e versa, sendo uma das doenças mais prejudiciais da cultura (DARIVA, 2011).
Rhizoctonia solani Kuhn, pertence ao filo Basidiomicota, ocorre mundialmente causando doenças economicamente importantes em uma grande variedade de plantas cultivadas. O fungo representa um grupo importante em termos econômicos e geneticamente variados, classificados como patógenos de solo, que causam danos consideráveis as espécies de plantas em todo o mundo, (VILGALYS e CUBETA, 1994). No Estado do Pará há registro de ocorrência sobre feijão (Phaseolus vulgaris L.), seringueira (Hevea sp.), maracujá (Passiflora edulis f. flavicarpa Deg.), laranjeira (Citrus sp.), mogno africano (Khaya ivorensis A. Chev.), jambu (Sphilanthes oleracea L.), açaí (Euterpe oleracea L.), Acacia sp., maparajuba (Manilkara bidentada (AD.C.). A. Chev.), bastão-do-imperador (Etlingera elatior Smith) capim braquiária (Braquiaria sp.) (VERZIGNASSI et al, 2008). No maracujazeiro, além do tombamento de mudas, provoca o secamento das folhas, podendo ocasionar a morte das plantas (COSTA et al, 2008).
São fungos que acarretam prejuízos à agricultura, causando danos aos vegetais, os quais necessitam de um controle biológico extremamente eficaz e inofensivo ao meio ambiente (OLIVEIRA et al, 2006b).
Na busca por novas alternativas de controle de doenças de plantas, estudos têm demonstrado a atividade antifúngica de óleos essenciais de algumas espécies de plantas medicinais. Neste sentido, o presente trabalho teve como objetivo avaliar o efeito de diferentes concentrações da óleoresina de Copaifera reticula na inibição do crescimento micelial in vitro de Fusarium oxysporum f. sp. passiflorae, Fusarium solani eRhizoctonia solani.
Os isolados de Fusarium oxysporum f. sp. passiflorae, Fusarium solani e Rhizoctonia solani foram obtidos de plantas de maracujazeiro apresentando sintomas característicos da doença, provenientes dos municípios de Parauapebas, Belém e Tomé-Açu respectivamente, os quais encontram-se preservados em óleo mineral no Laboratório de Fitopatologia da Embrapa Amazônia Oriental, Belém- Pa. Para uso experimental, os isolados foram cultivados em meio de cultura de batata dextrose ágar (BDA), incubado a 28 ºC, por 7 dias. A óleoresina foi incorporada no meio de cultura BDA sintético nas concentrações de 0, 1, 2 e 3% (v/v). Após a solidificação do meio, depositou-se um disco de 8 mm de diâmetro de micélio do fungo no centro de cada placa, onde as placas foram incubadas a 28°C. A determinação do crescimento micelial foi feita diariamente com auxílio de um paquímetro, até que o patógeno em um dos tratamentos atingisse uma das extremidades da placa. As avaliações foram realizadas em quinze, onze e três dias de avaliação, respectivamente, de acordo com o período de crescimento de cada espécie.
Com os dados obtidos, calculou-se o índice de velocidade de crescimento micelial (IVCM), utilizando-se a equação descrita por Oliveira (1991):
IVCM = ∑(D-Da)/N onde, IVCM = Índice de Velocidade de Crescimento Micelial; D = diâmetro médio atual da colônia; Da = diâmetro médio da colônia do dia anterior; N = número de dias após a inoculação.
O delineamento experimental foi inteiramente casualizado em esquema fatorial 3x4 (3 isolados fúngicos x 4 concentrações do óleo), totalizando 12 tratamentos com 5 repetições. Para comparação entre as variâncias médias de IVCM, os dados foram submetidos ao teste de Bartlett, quando um destes acusou diferença estatisticamente significante foi utilizado o teste da ANOVA para verificar a influência dos tratamentos sob a variável resposta (IVCM). Para as comparações múltiplas entre os tratamentos, utilizou-se o teste de Tukeyparafins decomparação de médias da variável resposta (IVCM) dos fungos analisados em função dos tratamentos realizados. Foi adotado nível de significância de 5%. Para a análise dos dados, utilizou-se o programa estatístico SISVAR.
A seguir, na tabela 1 são apresentados os resultados do efeito da óleoresina de Copaifera reticulata no comprimento micelial das três espécies fúngicas.
Tabela 1: Efeito da óleoresina de Copaifera reticulata na inibição
do crescimento micelial (cm) in vitro de fitopatógenos.
Fitopatógenos |
Concentração |
|||
0% |
1% |
2% |
3% |
|
F. oxysporum f.sp. passiflorae |
21,09aC |
18,87aBC |
16,82aAB |
15,55abA |
F.solani |
21,88aB |
21,35aB |
19,46bAB |
17,92bA |
R. solani |
54,48bC |
19,86aB |
16,38aA |
14,33aA |
CV % |
7,73 |
|||
Médias seguidas de letras minúsculas iguais na coluna e maiúsculas na linha não diferem significativamente a 5% pelo Teste de Tukey. Fonte: Autores, 2017.
Entre os tratamentos utilizados, ocorreu interação entre os fatores fitopatógenos e as concentrações empregadas (Tabela 1). Para os três fitopatógenos, a concentração de 3 % foi a mais eficiente para a inibição do crescimento micelial in vitro (Figuras 1, 2 e 3), embora não tenha ocorrido diferença significativa da concentração de 2%. Os menores crescimentos miceliais foram observados para F. oxysporum f.sp. passiflorae (15,55 cm) e R. solani (14,33 cm) registrados na presença de 3% da óleoresina. Para F. oxysporum f.sp. passiflorae, as concentrações de 2% e 3% da óleoresina reduziram significativamente o crescimento micelial em 20,25 e 26,27% (Figura 1) e para F. solani, apenas na concentração de 3%, houve redução significativa do crescimento micelial de 18,10% (Figura 2), onde se pode afirmar que a concentração de 3%, é a mais eficiente na redução desses fitopatógenos.
Os maiores crescimentos miceliais ocorreram na ausência da óleoresina com destaque para R. solani com 54,48 cm, onde, houve redução significativa no crescimento micelial a partir da concentração de 1%, sendo que as concentrações de 2% e 3% proporcionaram as maiores reduções, com 69,93 e 73,70% de inibição no crescimento micelial em relação à testemunha (Figura 3), respectivamente, não havendo diferença significativa entre esses dois tratamentos.
Figura 1. Inibição do crescimento micelial de Fusarium oxysporum f.sp. passiflorae
pela óleoresina de Copaifera reticulata em meio de cultura BDA, nas concentrações de 0 e 3%.
Fonte: Pires, 2016.

-----
Figura 2. Inibição do crescimento micelial de Fusarium solani pela óleoresina de
Copaifera reticulata em meio de cultura BDA, nas concentrações de 0 e 3%.
Fonte: Pires, 2016.

-----
Figura 3. Inibição do crescimento micelial de Rhizoctonia solani pela óleoresina
de Copaifera reticulata em meio de cultura BDA, nas concentrações de 0 e 3%.
Fonte: Pires, 2016.

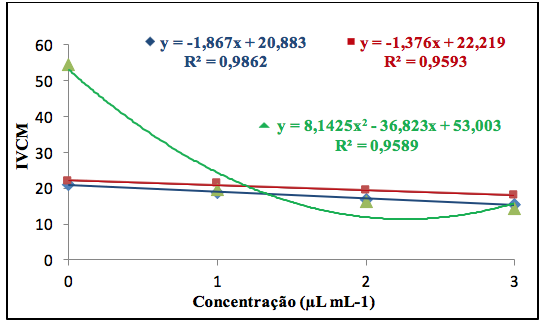
Foram observados que à medida que se aumentava a concentração da óleoresina ocorria a redução do crescimento micelial (Figura 4), demonstrando com isso a eficiência das concentrações da óleoresina na inibição do crescimento micelial in vitro quando comparada com a ausência do referido óleo.
Figura 4.Efeito da concentração da óleoresina de C. reticulata na inibição do
crescimento micelial in vitro de F. oxysporum, F. solani e R. solani. Fonte: Autores, 2017.
A eficiência desse controle pode ser atribuída a determinados sesquiterpenos presentes na óleoresina de Copaifera como o β-cariofileno que possui propriedades bactericida e antifúngica, bem como, a concentração utilizada da óleoresina (VEIGA JUNIOR e PINTO, 2002; TAPPIN et al., 2004). Trabalhos realizados por Oliveira et al (2006b); Lameira (2007); Pires et al (2015), através de experimentos com vários fitopatógenos, incluindo, Rhizoctonia solani demonstraram a eficiência da óleoresina de Copaifera reticulata Ducke na inibição do crescimento micelial in vitro corroborando com os resultados obtidos no presente trabalho.
Extratos hexânico e metanólico de folhas de Copaifera langsdorffi utilizado por Amorim (2003) promoveram a inibição do crescimento micelial de Colletrtrichum gloeosporioides e Bipolaris sorokiniana. Por sua vez Morais et al (2000) mostraram atividade positiva da óleoresina de Copaifera spp. sobre Fusarium oxyporum f. sp. lycopersici, enquanto Cascon et al (2000) testaram através do Bioautograma a ocorrência de atividade inibitória para Staphylococcus aureus para todas as amostras usadas de Copaifera duckei e C. spp. procedentes dos Estados do Amapá, Amazonas e Pará.
À medida que as concentrações da óleoresina de Copaifera reticulata Ducke são aumentadas maior é a eficiência obtida na inibição do crescimento micelial in vitro dos fitopatógenos Fusarium oxysporum f. sp. passiflorae, Fusarium solani eRhizoctonia solani.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e a Embrapa Amazônia Oriental.
Amorim, A. C. L. (2003). Caracterização quimica da Copaifera langsdorffi Desfon e avaliação de sua atividade fungitóxica. (Dissertação de Mestrado). Universidade Federal de Lavras. Lavras.
Cascon, V., Gilbert, B. Araujo, G. L. Rocha, L. M. Teixeira, L.A. & Carvalho, E. S. (2000). Avaliação da atividade antimicrobiana de óleo resina de Copaifera spp.Trabalho apresentado no Simpósio de plantas medicinais do Brasil, Recife. Recuperado de http://www.sbpmed.org.br/issn_01_1.php
Costa, A. de F. S., Costa, A. N. Ventura, J. A. Fanton, C. J. Lima, I. M. Caetano, L. C. S. & Santana, E. N. (2008). Recomendações técnicas para o cultivo do maracujazeiro. Trabalho apresentado pela Secretaria da Agricultura, Abastecimento Agricultura e Pesca, Vitória. Recuperado de biblioteca.incaper.es.gov.br/digital/bitstream/item/106/1/doc-162-tecnologias-producao-maracuja-cd-7.pdf
Dariva, J. M. (2011). Fusarioses do maracujazeiro: etiologia e sintomatologia. (Dissertação de Mestrado). Universidade Estadual de Montes Claros. Montes Claros.
Ishida, A. K. N. & Vieira- Halfeld, B. de A. (2009). Mancha bacteriana do maracujazeiro (Xanthomonas axonopodis pv. passiflorae): etiologia e estratégias de controle. Documentos. Embrapa Amazônia Oriental, Belém. Recuperado de https: www.infoteca.cnptia.embrapa.br/bitstream/doc/874307/1/maracujazeiro.pdf
Junior, V. F. V., & Pinto, A. C. (2002). O GÊNERO Copaifera L. Quim. Nova, 25(2), 273–286.
Lameira, C. N. (2007). Atividade do óleo- resina de Copaifera reticulata Ducke no crescimento micelial in vitro de fitopatógenos. (Dissertação de Mestrado). Universidade Federal Rural da Amazônia. Belém.
Morais, L. A. S de., CARMO, M. G. F. do. VIEGAS, E. C. de. & GILBERT, B. (2000). Atividade antifúngica do óleo-resina de copaíba (Copaifera spp.) e de frutos de sucupira (Pterodon ermaginatus) sobre Fusarium oxysporum f. sp. licopersici. Trabalho apresentado no Simpósio de plantas medicinais do Brasil, Recife. Recuperado de http://www.sbpmed.org.br/issn_01_1.php
Oliveira, J. A. (1991). Efeito do tratamento fungicida em sementes no controle de tombamento de plântulas de pepino (Cucumis sativas L.) e pimentão (Capsicum annanum L.). (Dissertação de Mestrado). Escola Superior de Agricultura de Lavras. Lavras.
Oliveira, E. C. P. de., Lameira, O. A., & Zoghbi, M. G. B. (2006a). Identificação da época de coleta do óleo-resina de copaíba (Copaifera spp.) no município de Moju, PA. Revista Brasileira de Plantas Medicinais, 8(3), 14–23.
Oliveira, E. C. P. de., Lameira, O. A., Barros, P. L. C. de., & Poltronieri, L. S. (2006b). Avalição do óleo de copaíba (Copaifera) na inibição do crescimento micelial in vitro de fitopatógenos. Revista de Ciências Agrárias/Amazonian Journal of Agricultural and Environmental Sciences, 46(1), 53–62.
Pires, H. C.G., Lameira, O. A. Ishida, A. K. N. & Silva, C. T. B. (2015). Efeitos dos óleos de andiroba e copaíba sobre Rhizoctonia solani Kuhn. Documentos. Embrapa Amazônia Oriental, Belém. Recuperado de https://www.embrapa.br/busca-de-publicacoes/-/publicacao/1022865/efeito-dos-oleos-de-andiroba-e-copaiba-sobre-rhizoctonia-solani-kuhn
Rigamonte-Azevedo, O. C., Wadt, P. G. S., & Wadt, L. H. de O. (2006). Potencial de produção de óleo-resina de copaíba (Copaifera spp) de populações naturais do sudoeste da Amazônia. Revista Árvore, 30(4), 583–591.
Silva, I., Miranda Neto, M. H., Franco, S. L., Cardoso, M. L. C., Molinari, S. L., Sant'ana, D. M. G.,... Iwanko, N. S. (1995). Noções sobre o organismo humano e utilização de plantas medicinais. Cascavel: Assoeste.
Tappin, Marcelo R. R., Pereira, Jislaine F. G., Lima, Lucilene A., Siani, Antonio C., Mazzei, José L., & Ramos, Mônica F. S. (2004). Análise química quantitativa para a padronização do óleo de copaíba por cromatografia em fase gasosa de alta resolução. Química Nova, 27(2), 236-240.
Vilgalys, R., & Cubeta, M. A. (1994). Molecular systematics and population biology of Rhizoctonia. Annual Review of Phytopathology, 32(1), 135–155.
1. Professora de Silvicultura e Recuperação de Áreas Degradadas. Universidade Federal Rural da Amazônia. E-mail: helainepires@yahoo.com.br
2. Pesquisador. Embrapa Amazônia Oriental (Laboratorio de Biotecnologia). E-mail: osmar.lameira@embrapa.br
3. Pesquisadora. Embrapa Amazônia Oriental (Laboratorio de Fitopatologia). E-mail: alessandra.ishida@embrapa.br
4. Técnica. Embrapa Amazônia Oriental (Laboratório de Fitopatologia). E-mail: clenilda.tolentino@embrapa.br
5. Engenheira Agronôma. Embrapa Amazônia Oriental (Laboratório de Fitopatologia). E-mail: alessandra_reis_freire@hotmail.com
6. Engenheira Florestal, Doutoranda. Universidade Federal de Lavras. E-mail: paula.amedeiros@hotmail.com