

Vol. 38 (Nº 27) Año 2017. Pág. 8
Kathlyn SCHAFRANSKI 1; Sabrina Ávila RODRIGUES 2
Recibido: 16/12/16 • Aprobado:24/01/2017
RESUMO: O repolho roxo detém elevada concentração de antocianinas, tornando-se uma matéria prima apropriada para extração de corante natural. Assim o objetivo deste trabalho foi avaliar a extração de antocianinas a partir do repolho roxo, em diferentes pH, temperatura e solventes, além de avaliar sua estabilidade ao longo do tempo em diferentes condições de armazenamento. Os extratos obtidos foram comparados a um corante sintético vermelho, avaliando-se a cor instrumental. As melhores condições de extração foram obtidas em álcool 25%, com pH 4,0 e 6,0 apresentaram maior coloração vermelha. Para avaliar a estabilidade dos pigmentos durante o armazenamento, foram selecionados os solventes água e álcool 25%, sendo realizadas leituras colorimétricas do parâmetro croma (C*) em relação ao padrão a cada sete dias durante quatro semanas, armazenados sob diversas condições, como exposição a luz, escuro e presença ou ausência de oxigênio. Os extratos obtidos em álcool 25% nas condições de pH6,0/oxigênio/escuro obteve melhor desempenho, e maior saturação da cor, mantendo-se estável em 21 dias. Portanto o repolho roxo apresentou-se como uma fonte natural de corante vermelho em meio ácido. |
ABSTRACT: The purple cabbage has a high concentration of anthocyanins, making it an appropriate raw material for natural dye extraction. Thus, the objective of this work was to evaluate the extraction of anthocyanins from the purple cabbage, in different pH, temperature and solvents, besides evaluating their stability over time in different storage conditions. The obtained extracts were compared to a synthetic red dye, evaluating the instrumental color. The best extraction conditions were obtained in alcohol 25% and water, with pH 4.0 and 6.0 showed greater red coloration. To evaluate the stability of the pigments during storage, 25% water and alcohol solvents were selected, and colorimetric readings of the chroma parameter (C *) were performed in relation to the standard every seven days for four weeks, stored under various conditions, such as exposure Light, dark and presence or absence of oxygen. The extracts obtained in alcohol 25% in the conditions of pH6.0 / oxygen / dark obtained better performance, and greater saturation of the color, remaining stable in 21 days. Therefore, purple cabbage presented as a natural source of red dye in acidic medium. |
Ao consumir um alimento, a cor é o primeiro atributo sensorial a ser observado, deste modo, para atender as expectativas dos consumidores, os quais frequentemente associam cor ao sabor e aroma, as indústrias alimentícias empregam o uso de corantes para conferir ou realçar a cor em determinados tipos de alimentos.
A adição de corantes em alimentos possui muitas finalidades, realçar a cor existente no próprio produto alimentício, apresentar uniformidade na cor, recompor a aparência original do alimento quando a cor é comprometida pelo processamento, além disso, alimentos que não possuem coloração, como o açúcar e o refrigerante, podem ser adicionados de corantes (HENRY,1996).
As indústrias alimentícias, gradativamente, estão buscando novas formas de melhorar e padronizar a cor de alimentos processados, que constantemente são afetados durante a produção em consequência a exposição dos alimentos a mudanças de temperatura, pH, luz e longos períodos de armazenamento.
Com a proibição do emprego de numerosos corantes artificiais, observa-se uma nova tendência na substituição por corantes naturais, de tal modo, que o consumo e a importância destes, apresentaram um aumento significativo nos últimos anos (CUNHA, 2008; MORITZ, 2005). Além de conferir ao produto uma aparência natural, aumentando a receptividade pelos consumidores, os corantes naturais vêm sendo utilizados há anos sem provas de malefícios a saúde (GOMES, 2012).
Neste contexto, as antocianinas que são compostas pelo maior conjunto de pigmentos solúveis em água do reino vegetal segundo Bridle; Timberlake (1997), vem sendo estudadas por serem agentes de coloração natural em alimentos. São encarregadas pelos tons que variam de vermelho vivo, violeta à azul (BOBBIO; BOBBIO, 1995). As antocianinas se encontram amplamente distribuídas na natureza, presentes em flores, frutos, vegetais, caules e raízes de plantas (MALACRIDA; MOTA, 2006).
A importância e a eficácia do emprego de antocianinas como corante natural se
deve ao fato de proporcionarem uma extraordinária cor vermelho brilhante em alimentos ácidos, como refrescos, compotas e doces, podendo ser utilizadas como substituto vegetariano para o carmim de cochonilha em produtos com baixo pH (DOWNHAM; COLLINS, 2000).
Porem as antocianinas apresentam características inconvenientes, como a deterioração exercida no decorrer da extração vegetal, no processo e na estocagem de alimentos em decorrência das variações de pH, temperatura, influência do oxigênio, enzimas e da interferência da luz em sua coloração (LOPES et al., 2007; GOMES, 2012).
Portanto é essencial estabelecer critérios de extração deste pigmento, de maneira que as antocianinas proporcionem o menor possível de alterações em suas propriedades, para posteriormente serem utilizadas (LOPES, 2002).
Das fontes naturais de corantes já pesquisadas, o repolho roxo detém elevada concentração de antocianinas. Segundo Idaka (1987); Nakatani et al., (1987); Ikeda et al., (1987), identificaram mais de 15 antocianinas existente neste vegetal. De acordo Bridle; Timberlake (1997); Chigurupati et al., (2002) o fato de ocorrer uma extensiva acilação nos pigmentos do repolho roxo proporcionam qualidades superiores na estabilidade e na coloração. Além disso, apresenta vantagem comercial por ser um vegetal de fácil acesso e de baixo custo.
Diante disto o objetivo deste trabalho foi avaliar a extração de antocianinas a partir do repolho roxo (Brassica oleracea), em diferentes condições de pH, temperatura e solventes, além de avaliar sua estabilidade ao longo do tempo em diferentes condições de armazenamento.
Os repolhos roxos (Brassica oleracea) foram adquiridos em supermercados da região. Todos os vegetais foram selecionados por avaliação visual e de consistência, apresentando o mesmo grau de maturidade.
As amostras foram conduzidas ao Laboratório de Vegetais da Universidade Tecnológica Federal do Paraná, Campus Ponta Grossa, PR.
Os solventes utilizados foram álcool etílico 96% e acetona com pH previamente ajustado a 4,0; 5,0 e 6,0.
Os vegetais foram submetidos à secagem em uma estufa com ventilação American Lab AL 100/630, a uma temperatura de 70ºC por 1 hora. Conforme Malacrida; Motta (2006), processos utilizando baixo tempo em altas temperaturas têm sido recomendados para melhor retenção dos pigmentos em antocianinas.
Após a secagem as amostras foram trituradas em liquidificador, e o pó obtido foi acondicionado em vidro envolto com papel alumínio e refrigerado até o momento de ser utilizadas.
O método de extração de antocianinas foi adaptado a partir do trabalho de Renhe (2008). Após secagem e moagem, utilizou-se 10 gramas do pó obtido para cada extração e completos até 100mL de solvente (álcool 25%, álcool 96% e acetona), com pH previamente ajustado (4,0; 6,0), levados para aquecimento em chapas aquecedoras, sob agitação. Quando atingida as temperaturas ideais (25ºC; e 75ºC), a amostra foi mantida sob aquecimento por trinta minutos. Após o tempo estabelecido o material foi filtrado em funil com papel filtro Qualy® 12,5 Ø, para reter as impurezas. Totalizando doze tratamentos.
As amostras obtidas representaram uma unidade experimental, e a combinação de um solvente com um nível de pH e um nível de temperatura caracterizando um tratamento de interesse. O ajuste do pH das soluções extratoras foi realizado com adição de HCl e NaOH em diferentes concentrações, utilizando o pHmetro Digital TEC-2 mp.
Foi realizado dentro do delineamento experimental um tratamento adicional com solvente água, com pH 5,0 a uma temperatura de extração a 50ºC, pois as antocianinas são altamente solúveis em água.
O extrato obtido do repolho roxo foi comparado a um padrão, o corante sintético vermelho II-V Arcolor, por se tratar de um corante largamente utilizado pelas indústrias alimentícias, e também pelo fato dos extratos obtidos neste experimento, apresentarem-se em soluções ácidas onde sua coloração aproxima-se da cor vermelha. A amostra padrão foi preparada com 10 miligramas do pó completo com 20mL de água.
A análise de cor instrumental foi avaliada em triplicata, conduzida em aparelho espectrofotômetro Ultra Scan PRO, lente de 0,19 in e ângulo de 8°. Os parâmetros avaliados foram os valores das coordenadas luminosidade (L*) que possui uma variação de zero (preto) a 100 (branco), as coordenadas verde/vermelho (a*) e azul/amarelo (b*), ambas com valores no intervalo de -60 a 60. Além destas coordenadas de cores, também foi conduzida a leitura dos valores de croma (c*), que representa a saturação ou intensidade da cor, e a medida do ângulo de tinta (h*) representando a tonalidade da cor.
Utilizou-se delineamento experimental fatorial diferenciado com 3 repetições, mais um tratamento adicional (solvente água) e um tratamento testemunha (padrão). Os resultados foram analisados estatisticamente pelo software ASSISTAT versão 7.7 beta, sendo realizada Anova e teste de Tukey, utilizando um nível de 5% de significância.
Para a avaliação da estabilidade da cor das antocianinas, consistiu em selecionar dois solventes com maior poder extrator a partir do delineamento experimental realizando-se uma nova extração, em condições ótimas de pH e temperatura. Submetidas a diferentes condições de armazenamento, avaliando-se as mesmas sob o efeito da luz, oxigênio e pH.
A temperatura de extração foi a 50°C média entre as temperaturas de 25ºC e 75ºC. O pH foi ajustado para 4,0 e 6,0 por representarem faixas utilizadas na maior parte dos alimentos. Adicionando-se 30 mL de solução tampão ácido cítrico (C6H8O7) para cada 100mL de extrato do repolho roxo, acrescentando sorbato de potássio para prevenir o crescimento de fungos.
Após extração as amostras foram acondicionadas em embalagens transparentes, uma parte recebendo luz de lâmpadas fluorescentes 40 w, 2500 lux, que corresponde a luz do dia, a uma distância de 50cm das embalagens em temperatura ambiente, outra parte das amostras armazenadas em local escuro com a mesma temperatura. Para simular a presença e a ausência de oxigênio, parte das amostras foram seladas a vácuo seladora Audionvac VM 101H. Totalizando oito tratamentos distintos O experimento é ilustrado na figura 1.
Figura 1. Fluxograma representativo da estabilidade do extrato
do repolho roxo em diferentes condições de armazenamento.
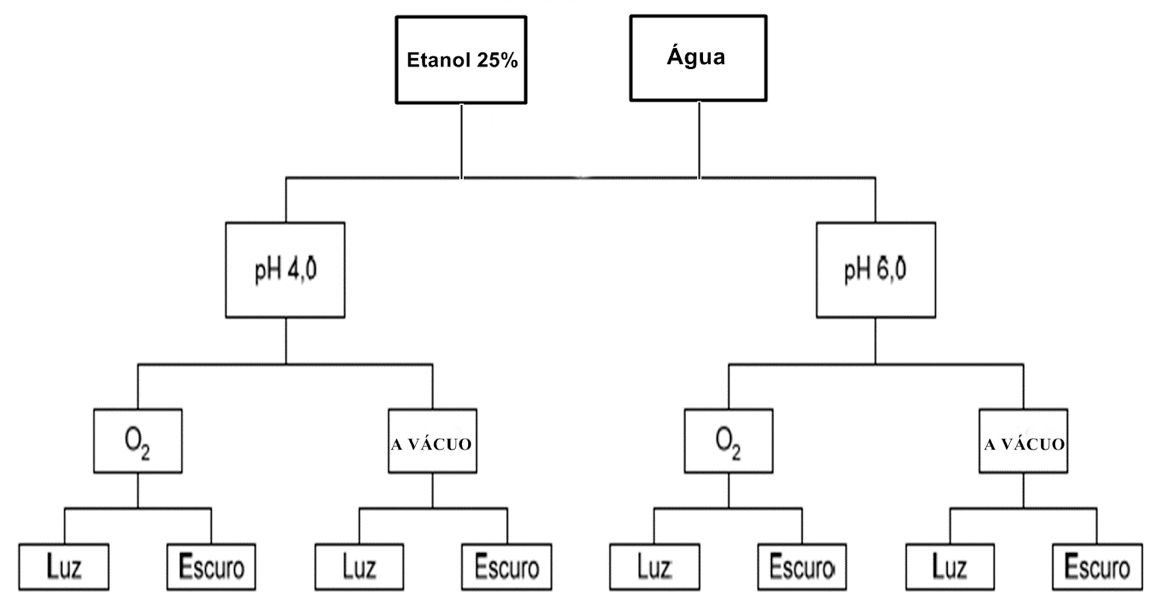
Fonte: autoria própria.
A cor instrumental medida em aparelho espectrofotômetro Ultra Scan PRO, lente de 0,19 in e ângulo de 8°, em triplicata. As leituras colorimétricas das médias e dos desvios em relação ao padrão foram feitas a cada sete dias durante quatro semanas. Os padrões representaram as amostras no tempo zero (imediatamente após extração). O parâmetro analisado foi a saturação ou intensidade da cor (C*).
Os resultados foram analisados estatisticamente pelo software ASSISTAT versão 7.7 beta, sendo realizada Anova e teste de Tukey utilizando um nível de 5% de significância.
As extrações foram realizadas conforme o delineamento experimental diferenciado com três repetições, mais um tratamento adicional (solvente água) e um tratamento testemunha (padrão). A Tabela 1 expressa os resultados experimentais, com as médias dos valores para análise de cor dos extratos antociânicos obtidos a partir das cascas do repolho roxo. Os resultados observados expõem a amplitude de cores do extrato estudado.¡Error! Vínculo no válido.
Tabela1- Média dos valores obtidos para os parâmetros de cor dos
extratos obtidos a partir do repolho roxo, em diferentes tratamentos.
Tratamentos |
Temperatura |
pH |
Solvente |
L* |
a* |
b* |
C* |
h |
1 |
25ºC |
4 |
Álcool 96% |
26,09 |
0,18 |
-0,13 |
0,25 |
313,05 |
2 |
|
Acetona |
26,09 |
0,43 |
-0,27 |
0,51 |
328,56 |
|
3 |
|
Álcool 25% |
26,48 |
1,56 |
-0,67 |
1,70 |
337,00 |
|
4 |
6 |
Álcool 96% |
26,13 |
-0,18 |
0,09 |
0,20 |
181,76 |
|
5 |
|
Acetona |
26,85 |
-0,19 |
0,61 |
0,64 |
106,96 |
|
6 |
|
Álcool 25% |
25,25 |
0,82 |
0,56 |
1,04 |
35,02 |
|
7 |
75ºC |
4 |
Álcool 96% |
26,18 |
0,15 |
0,15 |
0,24 |
106,51 |
8 |
|
Acetona |
26,13 |
0,09 |
0,19 |
0,22 |
129,85 |
|
9 |
|
Álcool 25% |
25,23 |
0,76 |
0,34 |
0,83 |
23,22 |
|
10 |
6 |
Álcool 96% |
25,34 |
-0,46 |
0,34 |
0,58 |
144,04 |
|
11 |
|
Acetona |
26,45 |
-0,54 |
0,23 |
0,60 |
155,16 |
|
12 |
|
Álcool 25% |
25,07 |
0,96 |
0,89 |
1,36 |
41,69 |
|
Adicional |
50ºC |
5 |
Água |
25,14 |
0,61 |
-1,44 |
1,58 |
293,65 |
Padrão |
6 |
Corante sintético |
25,08 |
1,27 |
1,24 |
1,82 |
45,03 |
Fonte: autoria própria.
Os extratos que apresentaram luminosidade (L*) mais próxima do padrão, foram o tratamento 12 e o tratamento adicional, indicando que os extratos solubilizados em água foram mais escuros. Segundo Bridle e Timberlake (1997), isto ocorre devido as antocianinas serem o maior grupo de pigmentos solúveis em água do reino vegetal.
As coordenadas de a* apresentaram menores valores nos ensaios 10 e 11, estes foram realizados com álcool 96% e acetona respectivamente, se distanciando da cor vermelha. Em virtude à elevada reatividade, as antocianinas degastam-se facilmente, originando o desenvolvimento de compostos incolores ou de pigmentação marrom e materiais insolúveis (MAZZA; BROUILLARD, 1987). Por serem polares e conter grupos hidroxilas, carboxilas, metoxilas e glicosilas residuais ligados aos seus anéis aromáticos, as antocianinas solubilizam com muita facilidade em água, auxiliando na extração e isolamento das antocianinas (HARBORNE; GRAYER, 1988). Já no tratamento 3, apresentou o maior valor para coordenada de a*, valor superior ao encontrado para o tratamento padrão. Isto se deve ao fato do elemento pH afetar diretamente a cor, em meio ácido, as antocianinas são vermelhas, porem ao aumentar o pH, há redução na intensidade da cor (MAZZA; BROUILLARD, 1987).
A maior saturação entre todas as amostras, indicada pela coordenada colorimétrica C*, foi observada quando foi utilizado como veículo de solubilização água e álcool 25%, enquanto que a tonalidade dos ensaios 6, 9 e 12, representada pela coordenada colorimétrica h*, mantiveram-se com os menores valores, indicando prevalência da cor vermelha. Este fato pode estar relacionado com o efeito da temperatura, Cacace; Mazza (2003) em seus estudos observaram que ao aumentar a temperatura de 6 para 30ºC, houve um acréscimo no rendimento e redução significativa no tempo de extração de antocianinas de groselhas pretas, com o emprego de solventes Álcool e água sulfurada, entretanto, a aplicação de temperaturas de extração de 40 e 70ºC ocasionou rendimentos inferiores em consequência à decomposição das antocianinas.
Em relação aos tratamentos 1, 2, 3 e o tratamento adicional, apresentaram para o parâmetro b* uma tendência para o azul, visto que, o tratamento adicional foi realizado a um pH 5,0. Habitualmente o isolamento da maior parte das antocianinas comuns, em solução aquosa mostram-se com um padrão geral de alterações estruturais. O cátion flavilium vermelho é a espécie dominante em soluções muito ácidas. Com o aumento do pH, uma série de reações químicas pode ocorrer protonação, levando à base quinoidal azul; hidratação do cátion flavilium, originando uma pseudobase incolor; tautomerização, responsável pela abertura do anel, resultando na forma cis-chalcona amarelo-pálida, e finalmente, isomerização para a forma trans-chalcona amarelo-pálida (LOPES et al., 2007).
Foi verificada interação tripla através análise de variância entre os fatores temperatura, pH e solvente (p <0,01), segundo a tabela 2.
Tabela 2- Quadro de análise do experimento fatorial ANOVA, teste de Tukey.
Variáveis |
SQ |
QM |
F |
p |
|
Temperatura |
0,0676 |
0,0676 |
2,1921 |
0,1497 |
ns |
pH |
0,1133 |
0,1133 |
3,6755 |
0,0653 |
ns |
Solvente |
5,6691 |
2,8345 |
91,9167 |
<0,0001 |
** |
Int. Temperatura x pH |
0,8464 |
0,8464 |
27,4466 |
<0,0001 |
** |
Int. temperatura x solvente |
0,3360 |
0,1680 |
5,4481 |
0,0100 |
* |
Int. pH x Solvente |
0,1485 |
0,0743 |
2,4078 |
0,1084 |
ns |
Int. temperatura x pH x solvente |
0,3905 |
0,1953 |
6,3317 |
0,0053 |
** |
Fat x T. adc+ Padrão |
5,3448 |
5,3448 |
173,3181 |
<0,0001 |
** |
T adc x Padrão |
0,0913 |
0,0913 |
2,9595 |
0,0963 |
ns |
In= Interação Fat=fatorial T.adc= Tratamento adicional
** significativo ao nível de 1% de probabilidade (p < 0,01)
* significativo ao nível de 5% de probabilidade (0,01 =< p < 0,05)
ns não significativo (p >= 0,05)
Fonte: autoria própria.
Os resultados indicaram que a variável solvente (p=0,0001), e as interações entre temperatura, pH e solvente (p= 0,0053) foram significativas com efeitos positivos. As três variáveis são responsáveis por afetarem linearmente os resultados dos pigmentos extraídos.
Conforme a metodologia de Matos (1997), extratos que contém antocianinas em meio lipofílico e hidrofílico ocasionam em uma extração deste elemento. E ao alterar o valor do pH do meio apresentará cores variadas. A figura 2 mostra a amplitude cores das antocianinas obtidas do extrato do repolho roxo.
Figura 2. Antocianinas obtidas a partir do extrato do repolho roxo

Fonte: autoria própria.
As antocianinas encontram-se nas células próximas à face exterior das plantas e no processo de extração são retiradas facilmente por solventes orgânicos. É comum o emprego de soluções acidificadas como álcool, acetona, água e misturas de acetona/álcool/água têm sido usadas para a extrair antocianinas (JU; HOWARD, 2003).
Conforme o delineamento experimental os solventes que se mostraram visualmente com maior poder extrator de pigmentos foram o álcool 25% e a água que em pH ácido apresentaram maior intensidade da cor vermelha. A acetona e o álcool 96% acabam tornando o processo de extração economicamente alta, e em concentrações altas degradam a antocianina resultando em compostos incolores, além de serem tóxicos a saúde.
Para auxiliar a avaliação desse experimento foi realizada análise de variância e as médias obtidas foram comparadas pelo teste de Tukey a 5% de probabilidade. Os dados foram analisados pelo programa estatístico Assistat versão 7.7 beta. As variáveis analisadas foram as médias e o desvio da cor em relação ao padrão do parâmetro de cromaticidade (C*).
Na Tabela 3 estão representados os valores das médias para a coordenada C* em diferentes condições de armazenamento ao longo do tempo extraídas em álcool 25%. Ao analisar as médias dos valores da intensidade das cores após sete dias, em relação aos tratamentos pH 6,0/oxigênio/luz e pH 6,0/oxigênio/escuro, houve diferença significativa, onde a amostra acondicionada em local escuro manteve a intensidade da cor. Stringheta (1991) em seus estudos, sugeriu que a implicação destrutiva da luz presentes nas antocianinas do capim gordura são abundantemente intensas, ligadas também ao pH. Dirby et. al., (2001); Carlsen; Stapelfeldt (1997) definiram o número aparente de foto-branqueamento de antocianinas provenientes do repolho roxo e do fruto do sabugueiro, ressaltando a baixa sensitividade à fotodegradação com valores de pH 3,0 a 3,8, respectivamente.
Através do teste de Tukey, pode-se observar que o tratamento pH6/oxigênio/escuro, teve a pigmentação degradada somente na terceira semana, esse resultado denota a importância do pH 6,0 e do escuro para alcançar um corante estável e com maior saturação. Várias literaturas atestaram que as antocianinas expressam alta estabilidade em pH ácido, onde também ocorre maior rendimento de extração (LOPES, 2002; KUSKOSKI, 2000; STRINGHETA, 1991; CASCON et al., 1994).
Tabela 3- Médias do parâmetro C* das antocianinas extraídas com
álcool 25%, ao longo do tempo em diferentes condições de armazenamento.
Tratamentos |
Tempo 0 |
Tempo 1 |
Tempo 2 |
Tempo 3 |
Tempo 4 |
pH4,0/ oxigênio / luz |
1,84 a |
1,15 b |
1,75 a |
1,02 b |
1,13 a |
pH4,0/ oxigênio / escuro |
1,84 a |
1,34 b |
1,76 a |
1,70 a |
1,04 a |
pH4,0/ vácuo/luz |
1,84 a |
1,81 a |
1,18 b |
1,66 a |
1,16 a |
pH4,0/ vácuo/escuro |
1,84 a |
1,74 a |
1,04 b |
1,51 ab |
1,08 a |
pH6,0/ oxigênio / luz |
1,90 a |
1,24 b |
1,77 a |
1,64 a |
1,12 a |
pH6/ oxigênio / escuro |
1,90 a |
1,90 a |
1,80 a |
1,37 ab |
0,83 a |
pH6,0/ vácuo/luz |
1,90 a |
1,98 a |
1,01 b |
1,56 ab |
1,43 a |
pH6,0/ vácuo/escuro |
1,90 a |
1,81 a |
1,12 b |
1,60 ab |
0,99 a |
*As médias na mesma coluna seguidas pela mesma letra não diferem estatisticamente entre si. Foi aplicado o teste de Tukey ao nível de 5% de probabilidade.
Fonte: autoria própria.
Os dados da Tabela 4 são referentes as médias dos tratamentos ao longo do tempo em diferentes condições de armazenamento, com os pigmentos do repolho roxo extraídos somente em água.
Nos tratamentos pH6/oxigênio/escuro e pH6/vácuo/luz no Tempo1, ou seja, após sete dias de armazenamento ouve diferença significativa ao nível de 5% de probabilidade entre os tratamentos. A existência de oxigênio no meio, assim como os outros fatores, acaba degradando as antocianinas, inclusive na ausência de luz, e todas as variações de pH. Ocorrendo através da oxidação direta ou indireta dos componentes do meio reagindo com as antocianinas. A precipitação e o aparecimento da turbidez em sucos de frutas eventualmente resultam da oxidação direta da base carbinol de antocianinas (JACKMAN; SMITH, 1992). Daravingas; Cain (1968), em suas pesquisas sobre a deterioração do pigmento do suco de framboesa, verificaram que o segundo motivo em ordem de relevância, posteriormente ao pH, na degradação do pigmento, era a existência do oxigênio molecular. Em todos os métodos empregados, ao substituir o oxigênio por nitrogênio, a antocianina se manteve estável.
Tabela 4- Médias do parâmetro C* das antocianinas extraídas com água,
ao longo do tempo em diferentes condições de armazenamento.
Tratamentos |
Tempo 0 |
Tempo 1 |
Tempo 2 |
Tempo 3 |
Tempo 4 |
pH4,0/ oxigênio / luz |
1,74 a |
1,41 bc |
1,34 b |
1,23 bc |
1,15 cd |
pH4,0/ oxigênio / escuro |
1,74 a |
0,82 d |
1,42 ab |
1,71 ab |
1,18 cd |
pH4,0/ vácuo/luz |
1,74 a |
1,60 abc |
1,72 a |
1,48 bc |
1,85 ab |
pH4,0/ vácuo/escuro |
1,74 a |
1,75 ab |
0,89 c |
2,04 a |
1,92 a |
pH6,0/ oxigênio / luz |
1,80 a |
1,40 c |
1,29 b |
1,28 bc |
1,37 bc |
pH6,0/ oxigênio / escuro |
1,80 a |
1,26 c |
1,21 bc |
1,47 bc |
0,83 d |
pH6,0/ vácuo/luz |
1,80 a |
1,88 a |
1,18 bc |
1,10 c |
2,03 a |
pH6,0/ vácuo/escuro |
1,80 a |
1,42 bc |
1,30 b |
0,98 c |
1,37 bc |
*As médias na mesma coluna seguidas pela mesma letra não diferem estatisticamente entre si. Foi aplicado o teste de Tukey ao nível de 5% de probabilidade.
Fonte: autoria própria.
De modo geral pode-se observar a inconstância dos valores de saturação nas amostras extraídas em solução aquosa, ou seja, a intensidade da coloração independente do tratamento, diminuiu e com o passar do tempo aumentou. Este fato pode estar relacionado com o aparecimento de fungos nas amostras, mesmo com a adição do sorbato de potássio.
As figuras 3 e 4 apresentam o comportamento do desvio em relação ao padrão extraídos com solvente álcool 25% e água, respectivamente, ao longo do tempo em diferentes condições de armazenamento. O menor desvio significa maior proximidade com o padrão (tempo 0).
Figura 3. Comportamento do desvio do parâmetro C* das antocianinas extraídas
com álcool 25%, ao longo do tempo em diferentes condições de armazenamento

Fonte: autoria própria.
Os resultados observados mostram que de forma geral para desvio em relação ao extrato obtido por solvente álcool 25%, a intensidade da cor manteve-se constante até a segunda semana (figura 3). O mesmo não ocorreu com o pigmento extraído somente em água, ouve um aumento do desvio em relação ao padrão após a primeira semana, ou seja, a intensidade da cor diminuiu (figura 4).
Figura 4. Comportamento do desvio do parâmetro C* das antocianinas
extraídas em água, ao longo do tempo em diferentes condições de armazenamento

Fonte: autoria própria.
As antocianinas apresentam características inconvenientes, como a deterioração exercida no decorrer da extração vegetal, no processo e na estocagem de alimentos. Este pigmento expressa maior estabilidade perante natureza acida, entretanto pode ocorrer degradação de diversas formas, inicialmente danos na cor, acompanhadas de tonalidades amareladas e desenvolvimento de substancias insolúveis, podendo explicar em alguns casos a queda do desvio em consequência aumentando a intensidade da cor.
O repolho roxo apresentou-se como uma fonte natural de corante vermelho em meio ácido, sendo possível obter este pigmento em água e álcool 25%, que são solventes de baixo custo, tornando o processo economicamente viável. Houve interação tripla entre as variáveis temperatura, pH e solvente.
Para os extratos obtidos com álcool 25% o tratamento nas condições de pH6,0/oxigênio/escuro obteve melhor desempenho, e maior saturação da cor, apresentando queda da intensidade do pigmento apenas na terceira semana, ou seja, em 21 dias manteve-se estável.
O corante natural extraído das antocianinas pode substituir o corante sintético, mediante outros métodos de conservação.
BOBBIO, P. A.; BOBBIO, F. O. Química do Processamento de alimentos. São Paulo: Livraria Varela Ltda. 1995. 151 p.
BRIDLE, P.; TIMBERLAKE, C.F. Anthocyanins as natural food colours selected aspects. Food Chemistry, v.58, n.1-2, p.103-109, 1997.
CACACE, J.E.; MAZZA, G. Mass transfer process during extraction of phenolic compounds from milled berries. J. Food Eng., vol 59, p 379-389, 2003.
CARLSEN, C.; STAPELFELDT, H. Light sensitivity of elderberry extract. Quantum yields for photodegradation in aqueous solution. Food Chemistry, v. 60, p. 383-387, 1997.
CASCON, S.C.; CARVALHO, M.P.M.; MOURA, L.L. Corantes de batata doce roxa para uso em alimentos. EMBRAPA, 1994. 25 p. (Boletim de pesquisa, 09).
CUNHA, F. G. Estudo da Extração Mecânica de Bixina das Sementes de Urucum em Leito de Jorro. 2008. 92p. Dissertação (Mestre em Engenharia Química), Faculdade de Engenharia Química, Universidade Federal de Uberlândia, Uberlândia, 2008. Orientador: Marcos Antonio de Souza Barrozo.
CHIGURUPATI, N.; SAIKI, L.; GAYSER JR., C. Evaluation of red cabbage dye as a potential natural color for pharmaceutical use. International Journal of Pharmaceutics, v. 241, n.2, p.293-299, 2002.
DARAVINGAS, G.; CAIN, R.F. Thermal degradation of black raspberry anthocyanin pigments in model system, Journal of Food Science, v. 33, p 138-142, 1968.
DIRBY, M.; WESTERGAARD, N.; STAPELFELDT. H., et al. Light and heat sensitivity of red cabbage extract in soft drink model systems. Food Chemistry, v. 72, p.431-437, 2001.
DOWNHAN, A.; COLLINS, P. Colouring our foods in the last and next millennium. International Journal of Food Science and Technology, v.35, p.5-22, 2000.
FRANCIS, F.J., Food Colorants: anthocyanins, Crit. Rev. Food Sci. Nutr., v.28, n.4, p.273-314, 1989.
GOMES, L. M. M. Inclusão de Carotenoides de Pimentão Vermelho em Ciclodextrinas e Avaliação da Sua Estabilidade, Visando Aplicação Em Alimentos. 2012. 108p. Dissertação (Mestre em Ciências Aplicadas), Faculdade de Farmácia, Universidade Federal Fluminense, Niterói, 2012. Orientadora: Kátia Gomes de Lima Araújo.
HARBORNE, J.B.; GRAYER, R.J., The anthocyanins. In: The flavonoids: advances in research since 1980. Chapmam & Hall, London, 1988, p. 1-20.
HENRY, B. S. Natural food colours. In: HENDRY, G. A. F.; HOUGHTON, J.D. Natural Food Colorants. 2.ed. Great Britain: Chapman & Hall, 1996. p. 40-79.
IACOBUCCI G.A.; SWEENY J.G., The chemistry of anthocyanins, anthocyanidins and related flavylium salts. Tetrahedron, v.39, p. 3005-3038, 1983.
IDAKA, E., Aciled anthocyanins from red cabbage, Patente japonesa 62,209,173, 1987.
IKEDA, K.; KIKUZAKI, H.; NAKAMURA, M.; NAKATANI, N., Structure of two aciled anthocyanins from red cabbage (Brassica oleracea), Chemistry Express, v.2, n.9, p.563-566, 1987.
JACKMAN, R.L.; YADA, R.Y.; TUNG, M.A.; SPEERS, R.A., Anthocyanins as food colorants. - A Review. J. Food Biochem. v.11, p.201-247, 1987.
JACKMAN, R.L.; SMITH, J.L. Anthocyanins and betalains. In: HENDRY, G.A.F. and HOUGHTON, J.D. Natural Food Colorants. London: Blackie Academic. p.183-241, 1992.
JU, Z. Y.; HOWARD, L. R. Effects of Solvent and Temperature on Pressurized Liquid Extraction of Anthocyanins and Total Phenolics from Dried Red Grape Skin. Journal of Agricultural and Food Chemistry, v. 51, n. 18, p. 5207-5213, 2003.
KUSKOSKY, E.M. Extração, identificação e estabilidade dos pigmentos dos frutos de báguaçu (Eugenia umberlliflora, Berg). Dissertação (Mestrado em Ciência dos Alimentos) – Universidade Federal de Santa Catarina, Florianópolis-SC, 113 f, 2000.
LOPES, T.J. Adsorção de antocianinas do repolho roxo em argilas. Dissertação
(Mestrado em Engenharia Química) – Universidade Federal de Santa Catarina, Florianópolis-SC, 121 f, 2002.
LOPES, T. J.; XAVIER, M. F.; QUADRI, M. G. N.; QUADRI, M. B. Antocianinas:
Uma breve revisão das características estruturais e da estabilidade. R. Bras. Agrociência, Pelotas, v. 13, n. 3, p. 291-297, 2007.
MALLACRIDA, S.R.; MOTTA, S. Antocianinas em suco de uva: composição e estabilidade. CEPPA, 24: 59 – 82, 2006.
MATOS, J. F. A. Introdução à Fotoquímica Experimental. 2 ed. Fortaleza: UFC Edições. 1997.
MAZZA, G.; BROUILLARD, R. Recent developments in the stabilization of anthocyanins in food products. Food Chemistry, Oxford, v.25, p.207-225, 1987.
MORITZ, D. E. Produção do Pigmento Monascus Por Monascus ruber CCT 3802 em Cultivo Submerso. 2005. 150p. Tese (Doutor em Engenharia Química), 63 Departamento de Engenharia Química e Engenharia de Alimentos, Universidade Federal de Santa Catarina, Florianópolis, 2005. Orientador: Jorge Luiz Ninow.
NAKATANI, N.; IKEDA, K.; NAKAMURA, M.; KIKUZAKI, H., Structure of diacyled anthocianins from red cabbage (Brassica oleracea). Chemistry Express, v.2, n.9, p. 555-558, 1987.
RENHE, Isis Rodrigues Toledo, M.Sc., Extração e Estabilidade do Corante Azul de Jenipapo (Genipa americana L.). 2008. 62p. Dissertação (Pós-Graduação em Ciência e Tecnologia de Alimentos), Universidade Federal de Viçosa, MG, 2008. Orientador: Paulo César Stringheta. Co-orientadores: Nilda de Fátima Soares e Tânia Toledo de Oliveira.
STRINGHETA, P.C.; Identificação da estrutura e estudo da estabilidade das antocianinas extraídas da inflorescência de capim gordura (Mellinis minutuflora, Pal de Beauv.), Campinas, 1991,138 p. Tese (Doutorado em Ciência e Tecnologia de Alimentos) – UNICAMP.
1. Universidade Tecnológica Federal do Paraná – UTFPR – Ponta Grossa/PR- Brasil kathlynschafranski@hotmail.com
2. Universidade Tecnológica Federal do Paraná – UTFPR – Ponta Grossa/PR- Brasil sabrinaqa2003@yahoo.com.br