

Vol. 39 (Nº 03) Año 2018. Pág. 19
Fabio FUENTES GANDARA 1; José PINEDO HERNÁNDEZ 2; José MARRUGO NEGRETE 3
Recibido: 10/09/2017 • Aprobado: 08/109/2017
RESUMEN: Se evaluaron las concentraciones de metales pesados en el tejido muscular y hepático de especies ícticas de la ciénaga de Mallorquín. Las muestras fueron analizadas por espectrometría de absorción atómica. Las concentraciones más altas de zinc, plomo y níquel se registraron en el hígado de la especie Mugil curema (28.71±14.1, 0.31±0.32, 0.22±0.07 μg/g, respectivamente), como también las de cromo (1.31±0.68 μg/g) pero en el tejido muscular. Por último, se evidenció que todas las especies capturadas están bioacumulando metales pesados en ambos tejidos, lo cual podría generar problemas de salud pública por la ingesta de estos peces. |
ABSTRACT: The concentrations of heavy metals were evaluated in muscle and liver tissue of fish species in the Mallorquín swamp. The samples were analyzed by atomic absorption spectrometry. The highest concentrations of zinc, lead and nickel were recorded in the liver of the species Mugil curema (28.71±14.1, 0.31±0.32, 0.22±0.07 μg/g respectively), as well as chromium (1.31±0.68 μg/g) but in muscle tissue. Finally, it was evidenced that all species captured are bioaccumulating heavy metals in both tissues, which could generate public health problems by the ingestion of these fish |
Los metales pesados constituyen un grupo de contaminantes que más genera impactos negativos en los ecosistemas acuáticos, situación que ha generado un aumento de la preocupación pública en todo el mundo, debido a su toxicidad, alta persistencia, bioacumulabilidad, biomagnificación y no biodegrabilidad en las cadenas alimentarias (De et al. 2010; Jarick et al. 2011; Gupta et al. 2016; Zhang et al. 2016). Éstos contaminantes químicos inorgánicos se emiten al medio ambiente de forma natural y antropogénica, incluyendo descargas de aguas industriales y urbanas, actividades agrícolas y portuarias, transporte acuático, lixiviación de vertederos, minería y depósitos atmosféricos (Yilmaz, 2007; Waltham & Connolly, 2011; Fu et al. 2014; Velusamy et al. 2014). Una vez incorporados en los cuerpos de agua se adsorben fácilmente en partículas y se precipitan en los sedimentos creando así una fuente potencial de contaminación, sobre todo para los organismos bentónicos los cuales están en contacto permanentemente con los sedimentos (Yi et al. 2012).
Los peces se encuentran en la parte superior de la cadena alimentaria de los ecosistemas acuáticos, por ende, pueden acumular grandes cantidades de metales pesados procedentes de alimentos, agua y sedimento (Zhao et al. 2012). Por lo tanto, los peces frecuentemente son utilizados como indicadores biológicos para conocer los niveles de los metales pesados en donde habitan y para evaluar los riesgos ecológicos ocasionados por las descargas de desechos antropogénicos (Zhou et al. 2008), de igual forma, esta problemática se ha convertido en un tema de interés mundial, no sólo por la amenaza para los peces, sino también a los riesgos de salud para los consumidores frecuentes (Rahman et al. 2012; Gu et al. 2016).
En Colombia, la contaminación química se ha detectado en las proximidades de las principales ciudades de la cuenca del Magdalena y los efluentes vertidos por las industrias de la Costa colombiana predominantemente de Cartagena y Barranquilla, y en menor grado de Riohacha, Santa Marta, Tolú, Coveñas y Turbo (UNEP, 2006). Las refinerías de gasolina, destilerías, el procesamiento de alimentos e industrias de embalaje (por ejemplo, carne, pollo, camarón y pescado), los fabricantes de pulpa y papel, y las industrias químicas son las principales fuentes de contaminación (INVEMAR, 2001).
La única laguna costera que tiene el departamento del Atlántico es la ciénaga de Mallorquín, la cual presenta característica estuarinas y fue declarada Sitio Ramsar (Decreto 3888, 2009 del Ministerio de Ambiente, Vivienda y Desarrollo Territorial). Su importancia ecológica radica en que sirve como hábitat para refugio, alimentación y reproducción de muchas especies, garantizando así la supervivencia y crecimiento de muchas larvas de muchos moluscos, crustáceos, peces y otros organismos. Sin embargo, no escapa a la problemática ambiental a la que están sometidos los cuerpos de agua de las zonas costeras, en ella se refleja un deterioro ambiental ocasionado en gran parte por la contaminación química vertida por las industrias de Barranquilla y por la acumulación progresiva de sedimentos provenientes del río Magdalena (UNEP, 2006).
En este cuerpo de agua se ha registrado contaminación por metales en el sedimento (Pedraza et al. 2009; Franco & León, 2010) y en las especies ícticas Mugil incilis y Eugerres plumieri (Sierra-Gutiérrez, 2003; García & Luque, 2008). Sin embargo, existe poca información sobre la bioacumulación de metales pesados en las demás especies ícticas presentes en la ciénaga de Mallorquín, situación que amerita una mayor atención debido a que es una gran fuente de recursos pesqueros, en ella habitan 36 especies ícticas pertenecientes a 22 familias. Las cuales pueden estar biocumulando metales pesados y representando un riesgo de salud pública ya que se estima que aproximadamente cuatrocientos habitantes del corregimiento La Playa consumen y expenden éstas especies (Arrieta & De La Rosa, 2003), por ende, en el presente estudio se determinaron las concentraciones de los metales pesados: cobre, zinc, cromo, níquel, plomo, cadmio y mercurio, tanto en el tejido hepático como el muscular de algunas especies ícticas que se encuentran generalmente durante todo el año y son de interés comercial.
La ciénaga de Mallorquín se encuentra ubicada en el centro de la costa norte de Colombia, departamento del Atlántico, entre el meridiano 74°52’00’’ de longitud oeste y el paralelo 11°05’00’’ de latitud norte (Figura 1). Hace parte de los 2250 km2 de la llanura aluvial septentrional inundable del río Magdalena (Galvis et al. 1992). Su forma es irregular e imprecisa, con un área de 2400 ha aproximadamente. Limita por el norte con el mar Caribe, por el sur con la avenida Circunvalar en el tramo que conduce del barrio Las Flores de Barranquilla con el corregimiento La Playa, por el oriente con el tajamar occidental del canal navegable del río Magdalena y por el occidente con la desembocadura del arroyo Grande, el cual aporta grandes volúmenes de agua en la época de lluvia el corregimiento de La Playa (CORMAGDALENA-CRA-UNINORTE, 1998).
Figura 1
Ciénaga de Mallorquín.
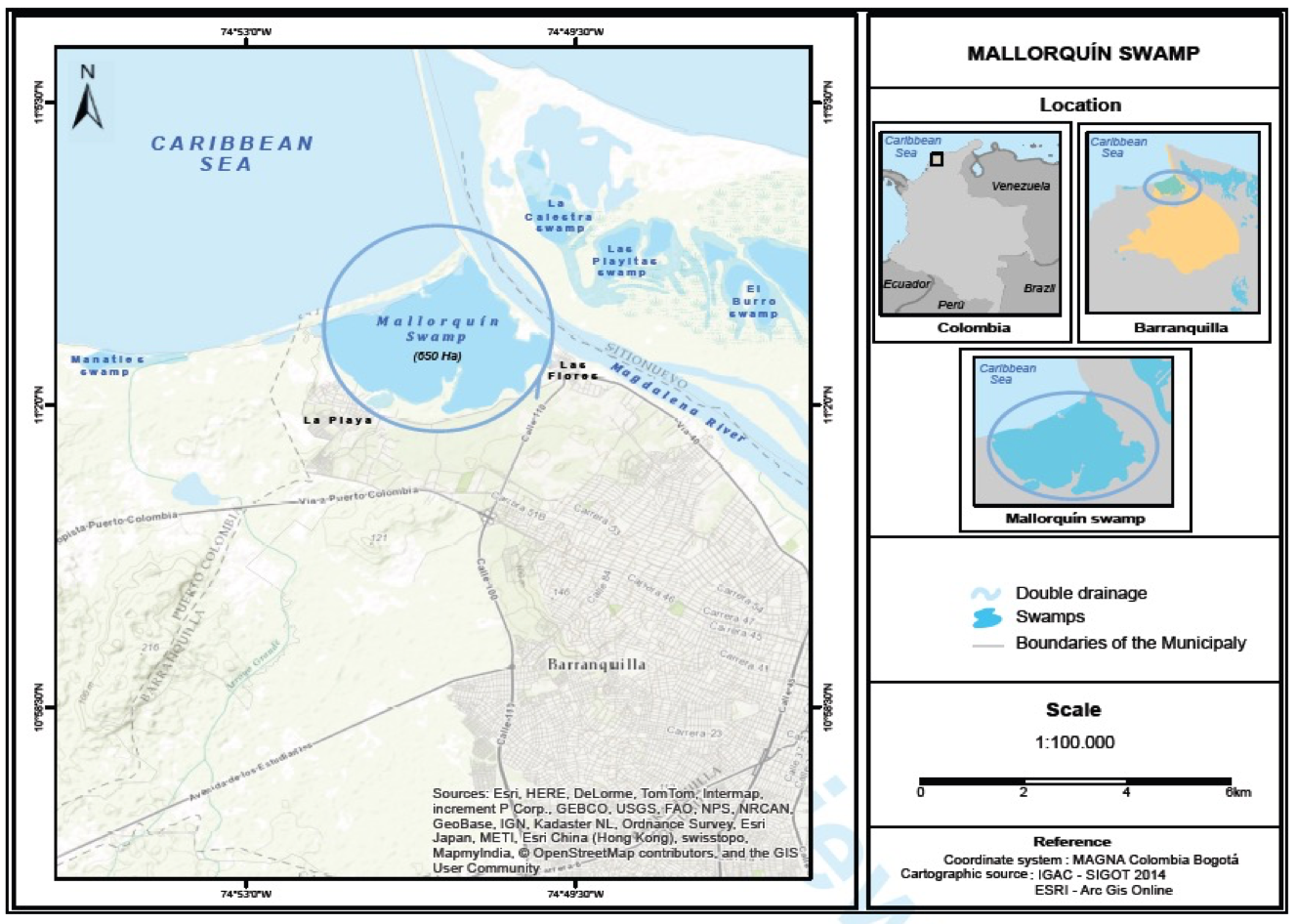
Fuente: Fuentes et al. 2016
Se seleccionaron cinco especies ícticas (Mugil curema, Eugerres plumieri, Arius bonillai, Centropomus undecimalis yLutjanus griseus) teniendo en cuenta su relación trófica en el ecosistema, por ser las más consumidas por los pobladores y porque están presentes en la pesquería durante todo el año. Un total de 56 especímenes fueron capturados por pescadores locales mediante dos campañas de muestreos realizadas en agosto del 2011 y febrero del 2012.
Los peces fueron empacados individualmente en bolsas de polietileno rotuladas y transportados al laboratorio. Después a los ejemplares se le determinó el peso y la longitud total y se procedió a extraer la muestra de tejido muscular siguiendo el procedimiento descrito por el UNEP/IOC/IAEA/FAO (1990), en el cual se removió la aleta pectoral del lado izquierdo junto a la piel, y con un cuchillo de teflón se cortó una porción de 3 cm de ancho, la piel se retiró con un tenedor de teflón y la muestra de músculo se depositó en un frasco de vidrio previamente lavado con una solución de HNO3 al 5% y agua desionizada. Además, se realizaron disecciones para extraer las muestras del tejido hepático las cuales fueron empacadas individualmente al igual que las muestras del tejido muscular.
Posteriormente, las concentraciones de HgT fueron determinadas por espectrofotometría de absorción atómica con vapor frío (CV-AAS) después de la digestión de las muestras (0.5 g peso húmedo) con H2SO4/HNO3, relación 2:1 v/v durante 2h a temperatura entre 100 - 110°C (Sadiq et al. 1991). El análisis de los demás metales (Cd, Cu, Pb, Cr, Ni y Zn) se realizó por espectrofotometría de absorción atómica con horno de grafito después de digestión de muestra (0.5 g peso húmedo) asistida con microondas empleando HNO3/HCl, relación 3:1 v/v durante 3h a 95 °C (Karadede & Ünlü, 2007). El control de calidad analítica del método se realizó con material de referencia certificado IAEA 407 y el porcentaje de recuperaciones varió de 91% a 98%.
El resultado del análisis para cada especie se presentó como el promedio (±) las desviaciones estándares de las muestras analizadas. A los datos se les aplicó un análisis exploratorio con la prueba de Kolmogorov-Smirnov para validar el supuesto de normalidad. En orden de establecer las asociaciones entre variables fue implementado el coeficiente de correlación lineal de Pearson (r) y el análisis estadístico fue realizado con el programa SPSS 10.5, con un nivel de significancia de p ≤ 0.05.
La Tabla 1 muestra los resultados de las especies ícticas capturadas durante el estudio en la ciénaga de Mallorquín. Las especies A. bonillai, C. undecimalis y L. griseus son carnívoras, la especie M. curema se destaca por tener hábitos detritívoros y la especie E. plumieri por presentar hábitos eurifágicos. La especie que presentó los mayores promedios de longitud total fue M. curema con 25.2 ± 2.6 cm. El mayor peso lo registró la especie A. bonillai con un promedio de 142.2 ± 100.2 g. Los menores promedios de la longitud total y el peso los presentó la especie E. plumieri con valores de 16.6 ± 0.9 cm y 57.3 ± 9.8 g, respectivamente.
Tabla 1
Especies ícticas capturadas en la ciénaga de Mallorquín.
Nombre científico |
Nombre común |
Número de individuos |
Longitud total |
Peso |
M. curema |
Lisa |
20 |
25.2±2.6 |
135.2±53.1 |
A. bonillai |
Chivo |
15 |
24.2 ±5.2 |
142.1±100.2 |
C. undecimalis |
Robalo |
11 |
24.6 ±4.1 |
119.0±46.0 |
L. griseus |
Pargo mulata |
6 |
18.2±2.6 |
92.3±35.1 |
E. plumieri |
Mojarra rayada |
4 |
16.6 ±0.9 |
57.3 ±9.8 |
Las concentraciones de los metales pesados en las muestras analizadas de tejido muscular se presentan en la Tabla 2. Todas las especies presentaron un orden muy disímil; A. bonillai; Zn>Cu>Cr>Ni>Pb>Hg>Cd, C. undecimalis; Zn>Cu>Pb>Cr>Hg>Cd>Ni, L. griseus; Zn>Cu>Cr>Hg>Pb>Ni>Cd, E. plumieri; Zn>Cu>Cr>Hg>Pb>Ni>Cd y M. curema Zn>Cr>Cu>Pb>Ni>Hg>Cd. Los promedios más altos de las concentraciones de Zn (17.36 µg/g), Cr (1.31 µg/g) y Pb (0.18 µg/g) fueron registrados en M. curema, en cambio los de Cu (0.64 µg/g) y Hg (0.16 µg/g) se obtuvieron en E. plumieri. Con relación al níquel A. bonillai presentó el mayor promedio (0.16 µg/g) y el promedio más alto de cadmio (0.06 µg/g) fue encontrado en C. undecimalis.
Tabla 2
Concentraciones de metales presentes en el tejido muscular. Los resultados
son expresados como M±S: promedio-desviación estándar y rango
(mínimo-máximo) µg/g, peso húmedo
|
Especies |
||||
Metales |
M. curema |
A. bonillai |
C. undecimalis |
L. griseus |
E. plumieri |
Cu |
0.51±0.27 (0.19-1.09) |
0.49 ±0.08 (0.38-0.69) |
0.37 ±0.12 (0.1-0.65) |
0.46 ±0.22 (0.13-0.73) |
0.64 ±0.45 (0.31-1.32) |
Zn |
17.36±8.03 (8-34.5) |
11.81±3.83 (7–20.1) |
12.14 ±3.74 (7.6 –18.2) |
16.46 ±5.53 (9.7- 24.3) |
2.92±0.40 (2.6-3.5) |
Cr |
1.31±0.68 (0.45-2.83) |
0.39 ± 0.25 (0.12-0.91) |
0.14 ±0.09 (0.04-0.32) |
0.16 ±0.09 (0.07-0.29) |
0.17±0.04 (0.11-0.23) |
Ni |
0.15±0.06 0.06-0.31 |
0.16 ±0.06 (0.06-0.28) |
0.05 ±0.04 (0.01-0.14) |
0.06±0.03 (0.02-0.09) |
0.06 ±0.01 (0.04-0.07) |
Pb |
0.18±0.17 0.01-0.65 |
0.15±0.09 (0.05-0.37) |
0.17±0.03 (0.12-0.22) |
0.11±0.03 (0.09-0.19) |
0.08±0.01 (0.06–0.1) |
Cd |
0.05±0.01 0.02-0.09 |
0.04±0.02 (0.01-0.09) |
0.06±0.03 (0.01-0.12) |
0.05±0.02 (0.01-0.08) |
0.05±0.03 (0.01-0.08) |
Hg |
0.08±0.02 0.05-0.13 |
0.12±0.05 (0.04-0.21) |
0.13±0.03 (0.09-0.22) |
0.15 ±0.02 (0.13-0.19) |
0.16±0.04 (0.10-0.19) |
Por otra parte, las correlaciones más significativas (r=0.97) se mostraron entre los niveles de Cr/Zn, Cr/Ni y Hg/Ni en las especies M. curema, L. griseus y E. plumieri, respectivamente. También se encontraron fuertes correlaciones entre la longitud total y el peso con las concentraciones de cromo y níquel (r=0.80) en L. griseus. Además, se registraron correlaciones estadísticamente significativas entre la longitud total y los niveles de cadmio (r=0.90) en E. plumieri.
En la Tabla 3 se muestran los valores obtenidos de las concentraciones de los metales pesados halladas en el tejido hepático. En este órgano la acumulación de metales pesados también mostró tendencias muy diferentes. M. curema; Zn>Cu>Cr>Pb>Ni>Hg>Cd, A. bonillai; Zn>Cu>Ni>Cr>Pb>Hg>Cd, C. undecimalis; Zn>Cu>Cr>Pb>Hg>Ni>Cd, L. griseus; Zn>Cu>Cr>Hg>Pb>Cd>Ni y E. plumieri; Zn>Cu>Cr>Hg>Cd>Pb>Ni. Los mayores promedios promedios de Zn (28.71 µg/g), Cr (0.49 µg/g) Pb (0.31 µg/g) y Ni (0.22 µg/g) fueron obtenidos en M. curema, mientras que los de Cu (0.98 µg/g), Cd (0.11 µg/g) y Hg (0.18 µg/g) fueron hallados en E. plumieri.
Tabla 3
Concentraciones de metales presentes en el tejido hepático. Los resultados
son expresados como M±S: promedio-desviación estándar y rango
(mínimo-máximo) µg/g, peso húmedo.
|
Especies |
||||
Metales |
M. curema |
A. bonillai |
C. undecimalis |
L. griseus |
E. plumieri |
Cu |
0.76±0.37 (0.3-1.82) |
0.75±0.13 (0.58-1.1) |
0.58±0.19 (0.16-1) |
0.71±0.34 (0.2- 1.12) |
0.98±0.70 (0.48-2.02) |
Zn |
28.71±14.1 (12.5-58.9) |
12.3±6.41 (5.7- 26.5) |
14.68±5.4 (11.1-22.6) |
20.5±6.86 (12.1-30.2) |
3.77 ±0.70 (3-4.7) |
Cr |
0.49±0.20 (0.21-0.94) |
0.19±0.13 (0.03-0.46) |
0.24±0.13 (0.08-0.54) |
0.26±0.16 (0.11-0.49) |
0.30±0.02 (0.28-0.34) |
Ni |
0.22±0.07 (0.13-0.38) |
0.21±0.08 (0.07-0.36) |
0.10±0.05 (0.01-0.14) |
0.08±0.03 (0.05-0.12) |
0.05±0.00 (0.04-0.06) |
Pb |
0.31±0.32 (0.04-1.3) |
0.18±0.14 (0.03-0.57) |
0.23±0.06 (0.07-0.29) |
0.18±0.02 (0.15-0.22) |
0.09±0.01 (0.08-0.11) |
Cd |
0.07±0.01 (0.03-0.09) |
0.06±0.01 (0.02-0.09) |
0.09±0.02 (0.03-0.13) |
0.09 ±0.03 (0.05-0.15) |
0.11±0.04 (0.07-0.16) |
Hg |
0.11±0.02 (0.08-0.18) |
0.15±0.04 (0.06-0.23) |
0.14±0.01 (0.10-0.17) |
0.19±0.04 (0.14-0.27) |
0.20 ±0.05 (0.14-0.29) |
Por otra parte, los mayores coeficientes de correlaciones fueron encontradas en la especie L. griseus entre la longitud total y el peso con los niveles de plomo y entre los niveles de cromo y níquel (r=0.99). De igual modo, se presentaron correlaciones significativas entre el peso y las concentraciones de cromo y níquel (r=0.88), las concentraciones de plomo con las de cromo y níquel (r=0.81) y entre las de cadmio con mercurio (r=0.85). De la misma manera, se evidenciaron correlaciones fuertemente significativas entre la longitud total y el peso con los niveles de plomo (r=0.90) en C. undecimalis y entre la longitud total y los niveles de cadmio (r=0.92) en E. plumieri.
Los metales analizados en esta investigación no mostraron un patrón trófico definido, excepto el cromo en el tejido muscular, níquel en el tejido hepático y mercurio en ambos tejidos. Los contenidos de cromo y níquel disminuyeron en los peces de hábitos detritívoros a eurifágicos como lo reportado por Zhang et al. (2013) y Hao et al.(2013), lo que posiblemente indica que no hay una bioacumulación en estos metales particularmente con el cromo. Mientras los niveles de mercurio a excepción de la especie E. plumieri aumentaron de acuerdo al nivel trófico, lo cual indica que el mercurio probablemente se está biomagnificando a través de la cadena trófica.
Muchos estudios reportan correlaciones positivas entre los niveles tróficos y los niveles de mercurio en las cadenas alimenticias, indicando que el Hg se biomagnifica en organismos con niveles tróficos superiores (Carrasco et al. 2011; Signa et al. 2013; Muto et al. 2014). Sin embargo, las concentraciones más altas de Hg fueron encontradas en E. plumieri la cual presenta una dieta muy variada, alimentándose de gasterópodos, mísidos, anfípodos, copépodos, ostrácodos, bivalvos, detritus de plantas, poliquetos y nemátodos de vida libre (Pérez, 2005). Esta especie también se destaca por ser dermesal, por tanto, es probable que exista una relación entre sus contenidos de mercurio con los del sedimento superficial de la zona de estudio, tal como lo describe Carrasco et al. (2011).
Las concentraciones más altas de los metales analizados fueron encontradas en tejido hepático, excepto las del cromo que fueron registradas en el tejido muscular de la especie M. curema, este resultado posiblemente es generado por el alto enriquecimiento de tipo natural que tiene el humedal producto de la erosión y a la fisiología que presentan los especímenes con respecto a la capacidad de absorción y de excreción de este metal, lo cual conlleva a una biacumulación progresiva del mismo. Los resultados obtenidos en el estudio coinciden con otras investigaciones debido a que órganos como el hígado, riñones y branquias tienen actividades metabólicas, particularmente el hígado, tiende a bioacumular los niveles más altos de metales pesados que otros órganos (Zhao et al. 2012; Weber et al. 2013; Mziray et al. 2016).
La bioacumulación de los metales en los peces, dependen de la biodisponibilidad, de factores ambientales como el pH, la temperatura y la alcalinidad (Wagner & Boman, 2003), la especie del metal, la toxicocinética (absorción, distribución, biotransformación y excreción), toxicodinámica (Kennedy, 2011), también influyen las características específicas de cada especie, tales como los hábitos alimenticios, la edad, el tamaño, el sexo, los hábitats y el nivel trófico (Weber et al. 2013).
En ese sentido las concentraciones más altas de los metales esenciales (cobre y zinc) se registraron en el tejido hepático, resultado que es similar al de otras investigaciones (Rajkowska and Protasowucki, 2013; El-Moselhy et al. 2014; Dhanakumar et al. 2015; Ju et al. 2017). Este resultado puede ser atribuido a que estos metales son parte indispensable de las proteínas ricas en cisteína, las cuales son utilizadas para desintoxicar al organismo ante la presencia de sustancias toxicas (Wagner & Boman, 2003). En el hígado también se puedo evidenciar altos contenidos de metales no esenciales (cadmio y mercurio), lo cual podría generar un desplazamiento de los metales esenciales y la inhibición de melatoninas en los peces (de Boeck et al. 2010).
Por otra parte, al comparar los resultados de los metales en las especies ícticas con las investigaciones realizadas en el área de estudio, se evidencia que el INVEMAR (2005) encontró en el tejido muscular de especímenes del género Mugil niveles de cromo (0.3-3.41 µg/g), níquel (0.15-1 µg/g) y plomo (0.66-2.03 µg/g) superiores a los obtenidos en el presente estudio. Así mismo, Sierra-Gutiérrez (2003) registró mayores concentraciones de cadmio (0.06-0.16 µg/g). Sin embargo, las concentraciones de cobre y zinc tanto del INVEMAR (2005) (0.09-0.80; 13.88-21.36 µg/g, respectivamente) como las de Sierra-Gutiérrez (2003) (0.09-0.94; 16.6-27.88 µg/g, respectivamente) son inferiores a las reportadas en esta investigación, situación que refleja un aumento de la contaminación de la ciénaga durante este tiempo. De igual forma, (Franco & León 2012) detectaron en especímenes del género Mugil del departamento del Atlántico concentraciones de zinc (9.12±2.3 µg/g) y de cadmio por debajo a las encontradas en éste trabajo, no obstante, en el tejido hepático sus concentraciones de cobre (524.1±576.6 µg/g), zinc (41.99±14.8 µg/g) y cadmio (0.23±0.21 µg/g) fueron superiores a las halladas en esta investigación.
En Colombia existe la resolución 122 del 2012 emitida por el Ministerio de la Protección Ministerio de la Protección Social de Colombia, la cual establece el reglamento técnico sobre los requisitos fisicoquímicos y microbiológicos que deben cumplir los productos de la pesca, en particular pescados, moluscos y crustáceos para consumo humano. En este sentido se destaca los límites permitidos de tan sólo tres metales pesados (Hg, Pb y Cd) considerados como los de mayor toxicidad, evidenciándose un vacío con el resto de metales. Los límites permitidos para el mercurio, plomo y cadmio son de 0.5, 0.3 y 0.05 µg/g, respectivamente.
En el presente estudio las concentraciones de mercurio estuvieron por debajo del límite permitido. De igual modo, la mayoría de las concentraciones de plomo fueron inferiores al valor permitido, sin embargo, cinco especímenes correspondientes a las especies M. curema y A. bonillai presentaron concentraciones superiores. Con respecto al cadmio el 50 % de las muestras analizadas están por encima del límite permitido, lo cual evidencia que la laguna costera está recibiendo altas descargas de este elemento y podría generar un riesgo ecológico para la biota. La toxicidad del plomo afecta principalmente al sistema nervioso central, riñón y al tejido sanguíneo, su exposición prolongada puede provocar coma, retraso mental e incluso la muerte (Al-Busaidi et al. 2011; Bello et al. 2016), mientras que el cadmio causa una reducción de las funciones reproductivas, presión arterial alta, tumores y disfunción hepática (Satarug et al. 2010; Zaza et al. 2015)
Por otro lado, se encontraron varias correlaciones significativas entre los tejidos de las especies y los metales analizados, lo que puede indicar que las fuentes potenciales de contaminación de este humedal son muy dispersas en las que se destacan las descargas de aguas industriales, la incorporación de sedimentos y de contaminantes del río Magdalena, actividades marítimas, desarrollo urbano, uso de agroquímicos, lixiviados entre otras, por tanto se dificulta encontrar una tendencia marcada en las correlaciones.
Adicionalmente, las especies con hábitos tróficos carnívoros no registraron correlaciones altamente significativas entre las variables biométricas con las concentraciones de mercurio, cuyo resultado es similar al reportado por Ruiz et al. (2014). Igualmente, no se demostraron correlaciones entre la longitud de los peces con los niveles de cobre, lo cual coincide por lo establecido por Yi et al.(2012). Tampoco se encontraron correlaciones entre las variables biométricas con todos los metales evaluados, posiblemente, esto se debe a la variabilidad de fuentes de contaminación que están incorporando metales al humedal, al amplio rango de distribución que tienen la mayoría de las especies recolectadas las cuales pueden reflejar problemas de contaminación de otros ecosistemas y al tiempo de exposición de las especies con relación a los contaminantes.
Los resultados obtenidos en el actual estudio indicaron que todas las especies capturadas presentaron metales pesados en los tejidos analizados, lo cual podría generar un riesgo a la salud humana teniendo en cuenta que varios especímenes registraron concentraciones superiores al límite permitido por la normatividad ambiental de Colombia. Las concentraciones más altas de los metales fueron registradas para el zinc y las más bajas para el níquel. La especie Mugil curema fue la que bioacumuló los niveles más altos de zinc, cromo y plomo tanto en el tejido hepático como en el muscular. Por otra parte, los contenidos de cobre y zinc en el tejido muscular de las especies ícticas fueron mayores a los registrados por otros estudios realizados en la ciénaga de Mallorquín, lo cual refleja un aumento en el grado de contaminación de estos metales en la laguna costera. Por último, no se evidenciaron correlaciones altamente significativas entre la longitud y el peso de cada una de las especies con las concentraciones de los metales analizados.
Al-Busaidi, M., Yesudhason, P., Al-Mughairi, S., Al-Rahbi, W. A. K., Al-Harthy, K. S., Al-Mazrooei, N. A., & Al-Habsi, S. H. (2011). Toxic metals in commercial marine fish in Oman with reference to national and international standards. Chemosphere, 85(1), 67-73.
Arrieta, L., & De la Rosa, J. (2003). Estructura de la comunidad íctica de la Ciénaga de Mallorquín, Caribe colombiano. Boletín de Investigaciones Marinas y Costeras, 32: 231-242.
Bello, O., Naidu, R., Rahman, M. M., Liu, Y., & Dong, Z. (2016). Lead concentration in the blood of the general population living near a lead–zinc mine site, Nigeria: Exposure pathways. Science of the Total Environment, 542, 908–914.
Carrasco, L., Benejam, L., Benito, J., Bayona, J. M., & Díez, S. (2011). Methylmercury levels and bioaccumulation in the aquatic food web of a highly mercury-contaminated reservoir. Environment international, 37(7), 1213-1218.
CORMAGDALENA-CRA-UNINORTE. (1998). Estudio de factibilidad de la recuperación de la ciénaga de Mallorquín. Inf. Ejecutivo, Corporación Autónoma Regional del Atlántico, Barranquilla, 254 p.
De, T. K., De, M., Das, S., Ray, R., & Ghosh, P. B. (2010). Level of heavy metals in some edible marine fishes of mangrove dominated tropical estuarine areas of Hooghly River, North East Coast of Bay of Bengal, India. Bulletin of environmental contamination and toxicology, 85(4), 385-390.
De Boeck, G., Eyckmans, M., Lardon, I., Bobbaers, R., Sinha, A. K., & Blust, R. (2010). Metal accumulation and metallothionein induction in the spotted dogfish Scyliorhinus canicula. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 155(4), 503-508.
Dhanakumar, S., Solaraj, G., & Mohanraj, R. (2015). Heavy metal partitioning in sediments and bioaccumulation in commercial fish species of three major reservoirs of river Cauvery delta region, India. Ecotoxicology and environmental safety, 113, 145-151.
Decreto Número 3888. (2009). Humedales de interés internacional: Ministerio de Ambiente, Vivienda y Desarrollo Territorial. República de Colombia.
El-Moselhy, K. M., Othman, A. I., El-Azem, H. A., & El-Metwally, M. E. A. (2014). Bioaccumulation of heavy metals in some tissues of fish in the Red Sea, Egypt. Egyptian Journal of Basic and Applied Sciences, 1(2), 97-105.
Franco, A., & León, I. (2010). Geoquímica y concentraciones de metales pesados en un organismo de interés comercial (Corbula caribaea. D’orbigny, 1842) en la zona submareal superficial de la Ciénaga de Mallorquín-Atlántico. Boletín Científico CIOH No. 28, ISSN 0120-0542, Cartagena de Indias, Colombia, pp. 69–83.
Franco, A., & León, I. (2012). Bioacumulación de metales traza en Mugil incilis (hancoc k, 1830); una herramienta útil para el biomonitoreo de la contaminación metálica en el litoral costero del departamento del Atlántico – Colombia. “Mugil incilis bioindicador de la contaminación metálica del litoral costero”. Costas, 1, 98-106.
Fu, J., Wang, Q., Wang, H., Yu, H., & Zhang, X. (2014). Monitoring of non-destructive sampling strategies to assess the exposure of avian species in Jiangsu Province, China to heavy metals. Environmental Science and Pollution Research, 21(4), 2898-2906.
Fuentes-Gandara, F., Pinedo-Hernández, J., Marrugo-Negrete, J., & Díez, S. (2016). Human health impacts of exposure to metals through extreme consumption of fish from the Colombian Caribbean Sea. Environmental geochemistry and health, 1-14.
Galvis, O., Téllez. S., & Lora, A. (1992). Contribución al conocimiento de las características medio-ambientales de la ciénaga de Mallorquín. VIII Semin. Nac. Cien. Tecnol. Mar. CCO, Bogotá, 1, 483-489.
García, G., & Luque, M. (2008). Análisis de metales pesados (Cd, Cr, Fe, Pb y Zn) en el tejido muscular de la Mojarra Rayada Eugerres plumieri y en la Lisa Mugil incilis de la ciénaga de Mallorquín, Atlántico. Trabajo de grado. Universidad del Atlántico, Barranquilla.
Görür, F. K., Keser, R., Akçay, N., & Dizman, S. (2012). Radioactivity and heavy metal concentrations of some commercial fish species consumed in the Black Sea Region of Turkey. Chemosphere, 87(4), 356-361.
Gu, Y.G., Huang, H.H., Lin, Q., 2016. Concentrations and human health implications of heavy metals in wild aquatic organisms captured from the core area of Daya Bay's fishery resource reserve, South China Sea. Environ. Toxicol. Pharmacol. 45, 90–94
Gupta, V. K., Moradi, O., Tyagi, I., Agarwal, S., Sadegh, H., Shahryari-Ghoshekandi, R., ... & Garshasbi, A. (2016). Study on the removal of heavy metal ions from industry waste by carbon nanotubes: effect of the surface modification: a review. Critical Reviews in Environmental Science and Technology, 46(2), 93-118.
Ikemoto, T., Tu, N. P. C., Okuda, N., Iwata, A., Omori, K., Tanabe, S., ... & Takeuchi, I. (2008). Biomagnification of trace elements in the aquatic food web in the Mekong Delta, South Vietnam using stable carbon and nitrogen isotope analysis. Archives of environmental contamination and toxicology, 54(3), 504-515.
INVEMAR. (2001). Informe sobre el estado de los ambientes marinos y costeros en Colombia: 2000. Serie de documentos generales 3. Santa Marta. 138 p.
INVEMAR. (2005). Informe técnico primer monitoreo de metales pesados en aguas, sedimentos y organismos de la ciénaga de Mallorquín, Departamento del Atlántico.
Jarić, I., Višnjić-Jeftić, Ž., Cvijanović, G., Gačić, Z., Jovanović, L., Skorić, S., & Lenhardt, M. (2011). Determination of differential heavy metal and trace element accumulation in liver, gills, intestine and muscle of sterlet (Acipenser ruthenus) from the Danube River in Serbia by ICP-OES. Microchemical Journal, 98(1), 77-81.
Ju, Y. R., Chen, C. W., Chen, C. F., Chuang, X. Y., & Dong, C. D. (2017). Assessment of heavy metals in aquaculture fishes collected from southwest coast of Taiwan and human consumption risk. International Biodeterioration & Biodegradation.
Karadede-Akin, H., & Ünlü, E. (2007). Heavy metal concentrations in water, sediment, fish and some benthic organisms from Tigris River, Turkey. Environmental Monitoring and Assessment, 131(1), 323-337.
Kennedy, C.J., (2011). The toxicology of metals in fishes, in Encyclopedia of Fish Physiology: From Genome to Environment. In: Farrell, A.P. (Ed.), 3. Academic Press, San Diego, Calif, USA, pp. 2061–2068
Hao, Y., Chen, L., Zhang, X., Zhang, D., Zhang, X., Yu, Y., & Fu, J. (2013). Trace elements in fish from Taihu Lake, China: Levels, associated risks, and trophic transfer. Ecotoxicology and environmental safety, 90, 89-97.
Mziray, P., & Kimirei, I. A. (2016). Bioaccumulation of heavy metals in marine fishes (Siganus sutor, Lethrinus harak, and Rastrelliger kanagurta) from Dar es Salaam Tanzania. Regional Studies in Marine Science, 7, 72-80.
Muto, E. Y., Soares, L. S., Sarkis, J. E., Hortellani, M. A., Petti, M. A., & Corbisier, T. N. (2014). Biomagnification of mercury through the food web of the Santos continental shelf, subtropical Brazil. Marine Ecology Progress Series, 512, 55-69.
Pedraza, L., (2009). Análisis de metales pesados (Zn, Cu, Cd, Fe, Cr) en la Almeja tivela mactroides (Born 1778) de la Ciénaga de Mallorquín, Departamento del Atlántico. Trabajo de grado. Universidad del Atlántico, Barranquilla.
Pérez, L., (2005). La Ictiofauna del Refugio de Vida Silvestre Bocas del Polochic y la cuenca del lago de Izabal: composición, distribución y ecología. Universidad del Valle de Guatemala. Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura. 290 p.
Rahman, M. S., Molla, A. H., Saha, N., & Rahman, A. (2012). Study on heavy metals levels and its risk assessment in some edible fishes from Bangshi River, Savar, Dhaka, Bangladesh. Food Chemistry, 134(4), 1847-1854.
Rajkowska, M., & Protasowicki, M. (2013). Distribution of metals (Fe, Mn, Zn, Cu) in fish tissues in two lakes of different trophy in Northwestern Poland. Environmental monitoring and assessment, 185(4), 3493-3502.
Resolución 122. (2012). Reglamento técnico sobre los requisitos fisicoquímicos y microbiológicos que deben cumplir los productos de la pesca, en particular pescados, moluscos y crustáceos para consumo humano. Ministerio de Salud y Protección Social. República de Colombia.
Ruiz-Guzmán, J. A., Marrugo-Negrete, J. L., & Díez, S. (2014). Human exposure to mercury through fish consumption: Risk assessment of riverside inhabitants of the Urrá reservoir, Colombia. Human and Ecological Risk Assessment: An International Journal, 20(5), 1151-1163.
Sadiq, M., Zaidi, T. H., & Al-Mohana, H. (1991). Sample weight and digestion temperature as critical factors in mercury determination in fish. Bulletin of Environmental Contamination and Toxicology, 47(3), 335-341.
Satarug, S., Garett, S. H., Sens, M. A., & Sens, D. A. (2010). Cadmium, environmental exposure, and health outcomes. Environmental Health Perspectives, 118, 182–190
Sierra-Gutiérrez, F. (2003). Contenido de metales pesados (cobre, cadmio y zinc) en la lisa M. incilis de la ciénaga de Mallorquín (Atlántico). Trabajo de grado. Universidad del Atlántico, Barranquilla.
Signa, G., Tramati, C. D., & Vizzini, S. (2013). Contamination by trace metals and their trophic transfer to the biota in a Mediterranean coastal system affected by gull guano. Marine Ecology Progress Series, 479, 13-24.
Soto, D. X., Roig, R., Gacia, E., & Catalan, J. (2011). Differential accumulation of mercury and other trace metals in the food web components of a reservoir impacted by a chlor-alkali plant (Flix, Ebro River, Spain): Implications for biomonitoring. Environmental pollution, 159(6), 1481-1489.
UNEP/IOC/IAEA/FAO. (1990). Contaminant monitoring programmes using marine organisms: Quality Assurance and Good Laboratory Practice. Reference Methods for Marine Pollution Studies N°57.
UNEP. (2006). Isaza, A., Sierra-Correa, C., Bernal- Velasquez, M., Londoño, L. M., & Troncoso, W. Caribbean Sea/Colombia and Venezuela, Caribbean Sea/ Central America and Mexico, GIWA Regional assessment 3b, 3c. University of Kalmar, Kalmar
Velusamy, A., Kumar, P. S., Ram, A., & Chinnadurai, S. (2014). Bioaccumulation of heavy metals in commercially important marine fishes from Mumbai Harbor, India. Marine pollution bulletin, 81(1), 218-224.
Waltham, N. J., & Connolly, R. M. (2011). Global extent and distribution of artificial, residential waterways in estuaries. Estuarine, Coastal and Shelf Science, 94(2), 192-197.
Wagner, A., & Boman, J. (2003). Biomonitoring of trace elements in muscle and liver tissue of freshwater fish. Spectrochimica Acta Part B: Atomic Spectroscopy, 58(12), 2215-2226.
Weber, P., Behr, E. R., Knorr, C. D. L., Vendruscolo, D. S., Flores, E. M., Dressler, V. L., & Baldisserotto, B. (2013). Metals in the water, sediment, and tissues of two fish species from different trophic levels in a subtropical Brazilian river. Microchemical Journal, 106, 61-66.
Yi, Y., Yang, Z., & Zhang, S. (2011). Ecological risk assessment of heavy metals in sediment and human health risk assessment of heavy metals in fishes in the middle and lower reaches of the Yangtze River basin. Environmental Pollution, 159(10), 2575-2585.
Yılmaz, F., Özdemir, N., Demirak, A., & Tuna, A. L. (2007). Heavy metal levels in two fish species Leuciscus cephalus and Lepomis gibbosus. Food Chemistry, 100(2), 830-835.
Zaza, S., de Balogh, K., Palmery, M., Pastorelli, A. A., & Stacchini, P. (2015). Human exposure in Italy to lead, cadmium and mercury through fish and seafood product consumption from Eastern Central Atlantic Fishing Area. Journal of Food Composition and Analysis, 40, 148-153.
Zhang, X., Xu, Q., Man, S., Zeng, X., Yu, Y., Pang, Y., & Fu, J. (2013). Tissue concentrations, bioaccumulation, and biomagnification of synthetic musks in freshwater fish from Taihu Lake, China. Environmental Science and Pollution Research, 20(1), 311-322.
Zhang, Y., Lu, X., Wang, N., Xin, M., Geng, S., Jia, J., & Meng, Q. (2016). Heavy metals in aquatic organisms of different trophic levels and their potential human health risk in Bohai Bay, China. Environmental Science and Pollution Research, 23(17), 17801-17810.
Zhao, S., Feng, C., Quan, W., Chen, X., Niu, J., & Shen, Z. (2012). Role of living environments in the accumulation characteristics of heavy metals in fishes and crabs in the Yangtze River Estuary, China. Marine pollution bulletin, 64(6), 1163-1171.
Zhou, Q., Zhang, J., Fu, J., Shi, J., & Jiang, G. (2008). Biomonitoring: an appealing tool for assessment of metal pollution in the aquatic ecosystem. Analytica chimica acta, 606(2), 135-150.
1. Biólogo, Magíster en Ciencias Ambientales, docente del departamento de Ciencias Naturales y Exactas, Universidad de la Costa, Barranquilla-Colombia, ffuentes1@cuc.edu.co
2. Químico, Magíster en Ciencias Ambientales, docente del Departamento de Química, Universidad de Córdoba, Montería-Colombia, josejph@hotmail.com
3. Ingeniero Químico, PhD en Ciencias Químicas, docente del Departamento de Química, Universidad de Córdoba, Montería-Colombia, jlmarrugon@hotmail.com