

Vol. 39 (Nº 14) Ano 2018 • Página 18
Jaqueline Ferreira Daniel SANTOS 1; Klayto José Gonçalves dos SANTOS 2; Aracele Pinheiro Pales dos SANTOS 3; Clarice BACKES 4; Rafael Alves da Costa Ferro 5; Diogo Alves da Costa FERRO 6; Patrícia Fernanda PEIXER 7
Recebido: 05/12/2017 • Aprovado: 25x/01/2018
RESUMO: A influência da qualidade do sêmen bovino congelado sobre a fertilidade tem motivado o desenvolvimento de inúmeras pesquisas de avaliação da morfologia e da função espermática. Esta revisão aborda os principais parâmetros de avaliação da qualidade do sêmen bovino criopreservado usado na inseminação artificial e sua relação com a fertilidade. O objetivo do trabalho foi descrever a importância da qualidade do sêmen bovino criopreservado, através da elevação da fertilidade dos rebanhos, buscando aumentar a eficiência econômica da bovinocultura brasileira. |
ABSTRACT: The influence of the quality of the frozen bovine semen on the fertility has motivated the development of numerous researches of morphology and sperm function evaluation. This review addresses the main parameters of evaluation of the quality of cryopreserved bovine semen used in artificial insemination and its relation to fertility. The objective of this work was to describe the importance of the quality of cryopreserved bovine semen, by increasing the fertility of the herds, aiming to increase the economic efficiency of Brazilian bovine animals. |
Com destaque no cenário mundial do agronegócio a pecuária, atividade presente em todos os estados brasileiros é um setor de grande importância econômica. Nesse segmento se destaca a bovinocultura, ramificada em cadeia produtiva da carne e do leite. Os bons resultados quantitativos e qualitativos alcançados na produção de bovinos estão diretamente ligados ao clima tropical, à extensão territorial, ao uso de tecnologias, a capacitação profissional, a sanidade animal, o manejo reprodutivo animal, a nutrição animal e a segurança alimentar.
A importância do uso de tecnologias na bovinocultura brasileira vem sendo reconhecida, principalmente pela perspectiva de retorno financeiro por meio da eficiência nos sistemas de produção, intensificada com o uso de eficientes técnicas de manejo e biotecnologias aplicadas à reprodução animal. Proporcionando assim, o aumento da produtividade do setor pecuário, produzindo com sustentabilidade e competitividade, pela otimização do sistema de produção, através de maior produtividade por área, diminuição dos custos e maximização do uso de animais geneticamente superiores (EMERICK et al., 2011).
A avaliação e a seleção de animais são extremamente importantes no Brasil, devido ao enorme déficit de reprodutores geneticamente qualificados para atender à demanda dos pecuaristas, necessitando de cerca de 350 mil touros de reposição anualmente, considerando uma relação touro:vaca de 1:30 (COSTA E SILVA et al., 2013), tem levado a ascensão da inseminação artificial (IA) e da inseminação artificial em tempo fixo (IATF), isso graças a criopreservação do sêmen bovino.
A criopreservação do sêmen consiste na utilização de crioprotetores específicos que possibilitam o armazenamento das doses de sêmen, por período indeterminado em nitrogênio líquido a -196ºC.
É de suma importância a qualidade do sêmen para se obter bons percentuais de prenhez, uma vez que o uso de sêmen de má qualidade poderá prejudicar os resultados de todo o programa de inseminação artificial, pondo a perder todos os esforços empreendidos na preparação do rebanho e dos investimentos em tecnologia (SEVERO, 2009).
EMERICK et al. (2011) afirmaram que devido o uso de animais geneticamente superiores a demanda de sêmen criopreservado aumentou no Brasil nas últimas décadas, tornando-se essencial para a aplicação das biotécnicas reprodutivas inseminação artificial, transferência de embriões (TE) e fertilização “in vitro” (FIV), eliminando as limitações de tempo e distância.
A inseminação artificial empregada nos programas de melhoramento genético de bovinos é uma eficiente forma de dispersão de genes de animais geneticamente superiores no rebanho, graças ao congelamento de sêmen, o estoque da genética de importância para o rebanho e sua utilização em estações de monta, facilitando o manejo dos animais na fazenda (ABUD et al., 2014). Entretanto, apresenta como fator limitante de sua eficiência, o processo de criopreservação dos espermatozóides e a avaliação da sua viabilidade celular.
Os procedimentos de separação espermática permitem a recuperação de espermatozóides de melhor qualidade, exibindo maior proporção de movimento progressivo e de células morfologicamente normais, técnica extremamente importante considerando que um touro pode produzir até 500 doses de sêmen por ejaculado (DIAS et al., 2012).
O objetivo da realização do trabalho foi descrever a importância da qualidade do sêmen bovino criopreservado, através da elevação da fertilidade dos rebanhos, buscando aumentar a eficiência econômica da bovinocultura brasileira.
Os espermatozóides são células alongadas, recobertos pela membrana plasmática e são constituídos de uma cabeça que contém o núcleo e de uma cauda (flagelo) para motilidade celular. Eles desempenham um papel fundamental na fecundação devido ao DNA contido em seu núcleo (GARCIA e FERNÁNDEZ, 2001).
Na cabeça estão o núcleo e o acrossoma. O colo conecta a cabeça com o flagelo, que é dividido em peça intermediária, principal e terminal (GARNER e HAFEZ, 2004). Essas partes que compõem um espermatozóide bovino estão apresentadas na Figura 1.
Figura 1
Espermatozóide bovino.
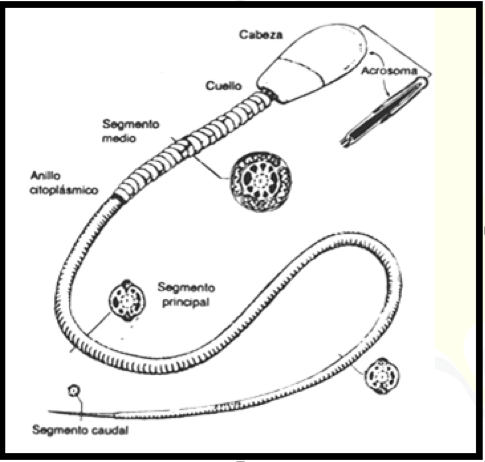
Fonte: GARNER e HAFEZ (2004).
A produção de espermatozóides é um processo contínuo, eles são produzidos nos túbulos seminíferos dos testículos e então transportados através dos testículos para o epidídimo, onde são armazenados e maturados (REECE, 2014). Após a maturação os espermatozóides estão prontos para serem liberados na ejaculação.
A cauda do epidídimo dos touros possui uma capacidade de armazenamento de até dez ejaculados sucessivos, onde os espermatozóides conseguem sobreviver por até 15 dias, entretanto após a ejaculação eles sobrevivem pouco mais de 24 horas (BARBOSA et al., 2012).
Segundo GARNER e HAFEZ (2004) o sêmen é definido como a suspensão celular líquida que contém os espermatozóides e as secreções dos órgãos acessórios do trato genital masculino, formando no momento da ejaculação o plasma seminal. As características e os componentes químicos do sêmen bovino podem ser observados abaixo na Quadro 1.
Quadro 1
Características e componentes químicos do sêmen bovino.
Característica do Componente |
Touro |
Volume do ejaculado (mL) |
5-8 |
Concentração espermática (milhões/mL) |
800-2000 |
Espermatozóides por ejaculado (bilhões) |
5-15 |
Espermatozóides móveis (%) |
40-75 |
Espermatozóides morfologicamente normais (%) |
65-95 |
Proteínas (g/100mL) |
6,8 |
pH |
6,4-7,8 |
Frutose (mg/100mL ± S.E.) |
460-600 |
Sorbitol (mg/100mL ± S.E.) |
10-140 |
Ácido cítrico (mg/100mL ± S.E.) |
620-806 |
Inositol (mg/100mL ± S.E.) |
25-46 |
Glicerilfosforilcolina (GPC) (mg/100mL ± S.E.) |
100-500 |
Ergotioneína (mg/100mL ± S.E.) |
0 |
Sódio (mg/100mL ± S.E.) |
225±13 |
Potássio (mg/100mL ± S.E.) |
155±6 |
Cálcio (mg/100mL ± S.E.) |
40±2 |
Magnésio (mg/100mL ± S.E.) |
8±0,3 |
Cloreto (mg/100mL ± S.E.) |
174±320 |
Fonte: Adaptado HAFEZ e HAFEZ (2004).
O sêmen liberado na ejaculação do touro é constituído por 10% de espermatozóides e líquido do canal deferente, cerca de 60% de líquido das vesículas seminais, 30% de líquido próstatico e uma pequena quantidade de líquido das glândulas bulbouretais (GUYTON e HALL, 2002).
Composto por íons, açúcares, proteínas, lipídeos, aminoácidos, ácido cítrico, minerais, fosfatases, prostaglandinas, potássio e citrato; o plasma seminal fornece condições favoráveis de sobrevivência aos espermatozóides (REECE, 2014). Constituído por vários tipos de açúcares como a frutose (principal açúcar do plasma seminal de touros), glicose, manose, galactose, arabinose, ribose, fucose, sorbitol e inositol; fornecendo substratos para produção de energia aos espermatozóides, sendo diretamente relacionadas com a fertilidade (ASSUMPÇÃO et al., 2013 b).
O volume do plasma seminal pode variar de acordo com a espécie e o sêmen pode ser diluído em taxas específicas garantindo que o volume da dose inseminante contenha espermatozóides suficientes para proporcionar alta fertilidade sem desperdiçar muitas células (HAFEZ, 2004).
Para iniciar a coleta de sêmen e obter bons ejaculados que possam ser congelados alguns cuidados referentes ao touro devem ser tomados. O sêmen bovino pode ser coletado por diferentes métodos levando em consideração o bem estar dos animais, um bom manejo e pessoas bem preparadas. Esses métodos utilizados são a eletroejaculação, a vagina artificial e a massagem das ampolas dos ductos deferentes (CARVALHO, 2014).
A criopreservação possibilita o armazenamento de células espermáticas por um longo prazo (BOSCARATO e MARTINS, 2014), e esse material genético pode ser utilizado nos programas de IA e IATF, e também na produção in vitro de embriões (PIVE).
A criopreservação de gametas traz inúmeras vantagens para a produção e reprodução de diversas espécies animais, por isso vários métodos são empregados para avaliar a conservação seminal entre elas a motilidade, as morfopatologias, a morfometria e a fertilização (ARAÚJO, 2010).
A célula espermática durante o processo de criopreservação é submetida a estresse mecânico, químico, osmótico e térmico entre 5ºC e -158ºC (FUJITA et al., 2013); gerando danos à membrana celular pela desestabilização da bicamada lipídica, que ocorre à medida que a temperatura diminuí e a membrana sofre uma transição de fase, passando da fase fluída para a fase de gel (BOSCARATO et al., 2016).
Os métodos de criopreservação de espermatozóides são relacionados com a estrutura funcional das membranas espermáticas e metabolismo celular, através da diluição, refrigeração, congelação, armazenamento e descongelação do sêmen (LUZ et al., 2011) e constituído de vários passos não fisiológicos, envolvendo o uso de um agente crioprotetor permeável, o resfriamento, o aquecimento e a remoção desse crioprotetor (ABUD et al., 2014).
O sucesso da congelação espermática está sujeito ao bloqueio completo de todos os processos metabólicos das células espermáticas. Foi a partir da década de 40 que a criopreservação do sêmen bovino teve grandes avanços decorrentes da descoberta da função crioprotetora do glicerol, entretanto, a preservação média da viabilidade espermática é de apenas cerca de 50% (CHACUR et al., 2012; GUERRA NETO et al., 2012). Esse baixo índice é resultado das diversas alterações bioquímicas e estruturais da célula espermática (acrossomo, núcleo, mitocôndrias, axonema, membrana plasmática) e até 85% dos espermatozóides bovinos sofrem algum tipo de injúria durante o processo de congelação/descongelação (CRESPILHO, 2007; BOSCARATO e MARTINS, 2014).
A função dos agentes crioprotetores é proporcionar nutrientes como fonte de energia; proteger contra o efeito prejudicial do resfriamento rápido; evitar variações de pH à medida que o ácido lático é formado; manter a pressão osmótica e o equilíbrio eletrolítico; inibir o crescimento bacteriano; aumentar o volume do sêmen e proteger os espermatozóides durante a congelação (HAFEZ, 2004).
A primeira etapa da criopreservação espermática é a diluição do sêmen em meios específicos para garantia da manutenção do movimento celular (PAPA et al, 2008). Sua composição influencia na sobrevivência espermática durante o processamento e na refrigeração ou congelação (CRESPILHO, 2007), fator crucial para a preservação da integridade espermática e habilidade de fertilização dos espermatozóides bovinos (PRADO et al., 2012).
O sêmen diluído é envasado em palhetas francesas de 0,25mL ou de 0,5 mL de forma manual, por meio de pipetas e/ou seringas ou automática, com envasador próprio para palheta (BERBER, 2009). O congelamento das palhetas de sêmen pode ser realizado através de sistema automatizado, onde a curva de resfriamento é controlada eletronicamente ou pelo sistema convencional em que a curva de resfriamento não é controlada (ABUD et al., 2014). Após o congelamento as palhetas são acondicionadas em hastes metálicas chamadas de raques e são armazenadas nos botijões de nitrogênio líquido (TEIXEIRA, 2009).
Os diluentes são substâncias iônicas e não-iônicas que mantêm a osmolaridade e tamponam o meio; são compostos por um crioprotetor, uma fonte de lipoproteína e aditivos (LEITE et al., 2011; BERTOL et al., 2014). Os principais crioprotetores bovinos são os açúcares: o glicerol, o etilenoglicol e o dimetilsulfóxido (DMSO) (MADEIRA et al., 2013; BERTOL et al., 2014). Como fonte de lipoproteína para proteger contra o choque térmico são usados a gema de ovo (FUJITA et al., 2013; MADEIRA et al., 2013), o leite de vaca integral homogeneizado, o leite desnatado fresco ou reconstituído, a água de coco e a lecitina de soja (LEITE et al., 2011). Os aditivos empregados na criopreservação são as enzimas antioxidantes e os antibióticos (LEITE et al., 2011; BERTOL et al., 2014).
A concentração espermática da dose inseminante é relacionada como um dos fatores que interferem na fertilidade do sêmen congelado (DIAS, 2010), o processo de diluição do sêmen contribui para o aproveitamento de um ejaculado para um maior número de fêmeas (CAVALERO et al., 2015), uma vez que os bovinos produzem ejaculados contendo uma maior quantidade de espermatozóides do que o necessário para a fecundação (ARAÚJO, 2010).
A diluição excessiva causa desestabilização da membrana devido à diminuição de fatores protetores do plasma seminal, que interferem na fertilidade pós-inseminação. Entretanto, em doses de sêmen com altas concentrações espermáticas, um dos problemas encontrados é o estresse oxidativo, onde o metabolismo dos espermatozóides gera grande quantidade de radicais livres (superóxido) e o não radical (peróxido de hidrogênio) (DUARTE JUNIOR et al., 2015; QUEIROZ et al., 2015).
As doses de sêmen comercializadas no Brasil utilizadas para inseminação artificial são padronizadas para os touros de alta fertilidade em 10x106 de espermatozóides e de até 15x106 de espermatozóides móveis por dose para os touros de fertilidade média a baixa (SEVERO, 2009). Porém, esse número representa apenas número de espermatozóides inseminados e não a porcentagem referente à fertilidade.
Existe a necessidade de obter informações mais objetivas acerca da porcentagem de espermatozóides móveis, pois esses dados precisos sobre o movimento espermático pode ser utilizada para prever o potencial de fertilidade ou selecionar o melhor procedimento para o processamento do sêmen (NASCIMENTO et al., 2015).
CRESPILHO (2007) considera que o número mínimo de espermatozóides necessários à elevação dos índices de concepção bovina é motivo para novas pesquisas e trabalhos, afinal determinar qual a melhor dose inseminante, reflete numa melhor relação custo/benefício, garante bons índices de fertilidade e controla a variação individual dos touros.
A qualidade do sêmen bovino corresponde ao conceito sobre o seu poder fecundante e sua relação com a fertilidade, onde o sêmen é congelado e depois descongelado para avaliação da qualidade dos espermatozóides (SEVERO, 2009).
O critério na avaliação da fertilidade seminal após o descongelamento é a taxa de espermatozóides móveis e que o critério para o sucesso da reprodução é a duração da motilidade espermática, que é inferior a um minuto, mas, muito importante para a fertilização (CELEGHINI et al., 2017), já que os espermatozóides precisam encontrar e penetrar a micrópila do ovócito antes do seu fechamento (DIAS, 2010).
Os touros selecionados para os centros de coleta e armazenamento do sêmen, considerados geneticamente superiores são escolhidos de acordo com suas características fenotípicas e genotípicas, e com a utilização da seleção genômica, o que possibilita a inclusão de animais jovens nos programas, sem a realização de testes de fertilidade a campo (CARREIRA, 2012). Por isso a avaliação da qualidade do ejaculado desses touros é de grande importância, bem como o conhecimento da fertilidade e qualidade do sêmen após o congelamento.
A qualidade do sêmen bovino sofre uma influência da idade ocasionada pela maturidade sexual, que ocorre entre 30 e 36 meses de idade nos Bos taurus indicus e entre 16 e 20 meses nos Bos taurus taurus (MELLO, 2014), além disso fatores ambientais, nutricionais, a raça e a idade do touro podem influenciar na qualidade do ejaculado (QUEIROZ et al., 2015).
Com a maturidade sexual do touro, a avaliação de sua fertilidade é baseada nas características do animal e do seu sêmen (ASSUMPÇÃO et al., 2013 a), que deve apresentar no mínimo 50% de motilidade espermática progressiva e morfologia espermática com no máximo 10% de defeitos espermáticos maiores e 20% de defeitos espermáticos menores (MONTEIRO et al., 2011; ASSUMPÇÃO et al., 2013 a; ARRUDA et al., 2015); conforme mostra a Figura 2.
Figura 2
Principais defeitos dos espermatozóides.
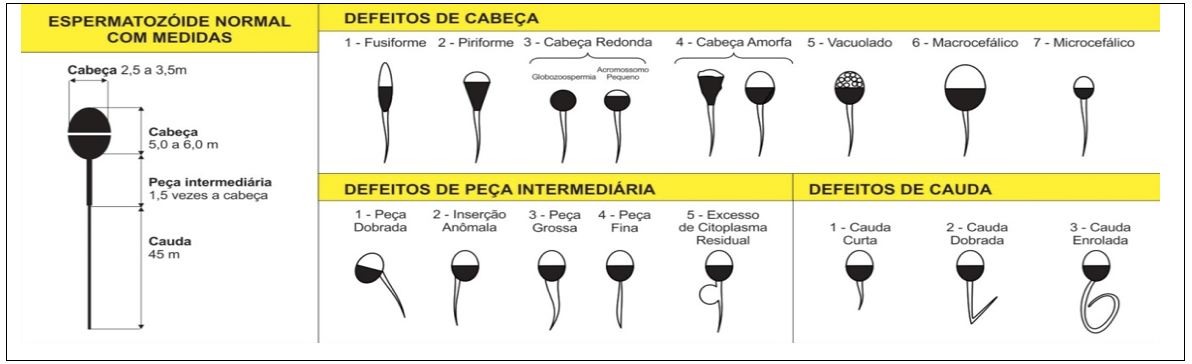
Fonte: MARQUES e MENDES, 2017.
A motilidade característica observada na avaliação da qualidade espermática após o processo de criopreservação (CARVALHO et al., 2009; CHACUR et al., 2012), vem sendo substituída pelo Sistema Computadorizado de Avaliação do Movimento Espermático (CASA), que é capaz de avaliar células móveis, imóveis e registra suas trajetórias individuais e as características do movimento (CHACUR et al., 2012; CARREIRA, 2012).
A qualidade do sêmen está amarrada a integridade e função de todas as estruturas que constituem o espermatozóide, como a membrana plasmática, o flagelo, as mitocôndrias, o acrossomo e a cromatina, que geralmente são avaliadas separadamente por diferentes técnicas e nem sempre correspondem à sua capacidade fecundante (ARRUDA et al., 2011).
Segundo SEVERO (2009) o sucesso na fertilização é resultado da correta manipulação do sêmen, da qualidade dos espermatozóides (características físicas e morfológicas adequadas) e de inseminadores capacitados e qualificados.
A correlação entre os parâmetros espermáticos e os índices de fertilidade ainda são variáveis, apesar do desenvolvimento de vários métodos de análise laboratorial do sêmen bovino congelado, todavia, nenhuma técnica de avaliação executada isoladamente apresenta sensibilidade suficiente para determinar a fertilidade, mas sim, a combinação dos diversos métodos de análises (LIMA 2014; CELEGHINI et al., 2017).
Na avaliação da fertilidade do touro a análise do sêmen é muito importante e pode ser realizada por diferentes métodos, entre eles a avaliação macroscópica, microscópica e análise das patologias espermáticas (TEIXEIRA, 2009); o Teste de Termorresistência (SIQUEIRA et al., 2007); e as avaliações do Sistema Computadorizado de Avaliação do Movimento Espermático (CASA) e do Citômetro (GUERRA NETO et al., 2012).
A análise macroscópica compreende a verificação do volume, coloração, odor, movimento de massa, densidade e pH do ejaculado (TEIXEIRA, 2009; OLIVEIRA et al., 2011; MIRANDA NETO et al., 2011).
A avaliação física microscópica do sêmen é realizada em microscópio óptico e são avaliadas a concentração, a motilidade, o turbilhonamento e o vigor (OLIVEIRA et al., 2011; MIRANDA NETO et al., 2011).
Para avaliar a concentração são utilizados a Câmara de Neubauer e/ou Espectrofotômetro, que determinam o número de espermatozóides por centímetro cúbico (TEIXEIRA, 2009).
A motilidade é avaliada imediatamente após a coleta de sêmen, representa a porcentagem de espermatozóides vivos e móveis, sendo classificada em graus que variam de 1 a 5 (Quadro 2), que correspondem à porcentagem e indicam a intensidade de deslocamento dos espermatozóides (BERBER, 2009).
Quadro 2
Classificação do ejaculado de acordo com a sua motilidade.
Grau |
Porcentagem de espermatozóides em movimento |
5 |
100 – 80% |
4 |
80 – 60% |
3 |
60 – 40% |
2 |
40 – 20% |
1 |
20 – 10% |
Fonte: Adaptado BERBER (2009).
O turbilhonamento é o movimento dos espermatozóides identificado em forma de ondas na observação de uma pequena gota de sêmen no microscópio ou na observação do ejaculado contra a luz; e é classificado numa escala de 0 a 5 (TEIXEIRA, 2009).
O vigor é avaliado na mesma lâmina da motilidade, observando a propulsão e a velocidade dos espermatozóides na lâmina, e classificando-os em graus de 0 a 5 (Quadro 3) (OLIVEIRA et al., 2011).
Quadro 3
Classificação da propulsão e velocidade dos espermatozóides.
Grau |
Propulsão e velocidade dos espermatozóides |
0 |
Estático – morto |
1 |
Moribundos – péssimos |
2 |
Lento – ruim |
3, 4 e 5 |
Bons |
Fonte: Adaptado BERBER (2009).
A Análise das patologias espermáticas identifica se há alteração na cabeça, na peça intermediária e na cauda do espermatozóide. Para identificar alterações na cabeça é realizado o esfregaço de sêmen fresco em lâmina corada, o corante penetra na célula morta, mas, a viva permanece incolor e são avaliados 200 espermatozóides (TEIXEIRA, 2009).
Para avaliar alterações na peça intermediária e na cauda do espermatozoide é usado o método de câmara úmida, colocando uma gota de sêmen em formol/salina numa lâmina com lamínula vedada com esmalte e são avaliados 200 espermatozóides (SILVA et al., 2003).
Desenvolvido por Dimitropoulos em 1967, o Teste de Termorresistência (TTR) busca avaliar a fertilidade potencial de partidas de sêmen bovino congelado, que posteriormente foi adaptado para as demais espécies (SIQUEIRA et al., 2007).
O TTR possibilita verificar a resistência dos espermatozóides à incubação, através da avaliação da porcentagem de espermatozóides móveis na dose inseminante (BORGES-SILVA et al., 2015) o que apresenta correlação positiva e altamente significativa com a fertilidade real.
Posteriormente Dimitropoulos adaptou o Teste de Termorresistência para duas versões: o Teste de Termorresitência Lento (TTR/L) e o Teste de Termorresitência Rápido (TTR/R) (SIQUEIRA et al., 2007).
No TTR/L a prova consiste na incubação de uma amostra de sêmen à 37ºC durante 5 horas, verificando a porcentagem de motilidade progressiva e o vigor dos espermatozóides a cada 30 minutos (SEVERO, 2009).
Já no TTR/R, a amostra de sêmen é colocando em banho-maria a 45°C por 30 minutos e depois avaliada a porcentagem de motilidade progressiva e o vigor dos espermatozóides (VASCONCELOS FILHO, 2010).
Para avaliação espermática os parâmetros mais utilizados são as características físicas como o total de espermatozóides na amostra, a motilidade espermática progressiva, o vigor, o número de espermatozóides viáveis e a morfologia espermática (defeitos maiores, menores e totais) (MARTINS et al., 2012; CELEGHINI et al., 2017). Porém, por serem considerados subjetivos, estes parâmetros têm se mostrado limitados quanto à capacidade de predizer o potencial de fertilidade do sêmen e veem sendo substituídos por outros como o Sistema Computadorizado de Avaliação do Movimento Espermático (CASA) e o Citômetro (GUERRA NETO et al., 2012).
O método CASA é um sistema automático com hardware e software que permite a avaliação exata e objetiva da motilidade, fornece informações precisas e significativas da cinética da célula espermática, determina a porcentagem de células móveis na amostra e quantifica características específicas do movimento espermático (ARRUDA et al., 2011).
O CASA é programado com uma micrometragem mínima e máxima para identificação dos espermatozóides de acordo com a espécie animal. As imagens dos espermatozóides são capturadas pelo estroboscópico acoplado ao computador, que digitaliza as imagens, formando um vídeo do trajeto, obtido pelas marcações de pontos onde a cabeça do espermatozóide está em cada foto e eles são classificados em móvel não progressivo, linear lento, linear rápido e imóvel (BERGSTEIN et al., 2014).
Segundo Arruda et al., (2011) e Bergstein et al., (2014) os parâmetros gerados da análise espermática realizada pelo CASA são:
O uso de análises computadorizadas e sondas fluorescentes por meio de microscopia de Epifluorescência ou Citometria de Fluxo são métodos utilizados em diversas espécies, devido a sua maior acurácia sobre a qualidade do sêmen (NASCIMENTO et al., 2015).
As amostras coradas pelas sondas fluorescentes são avaliadas em microscópio de fluorescência ou em Citômetro de fluxo. Esses corantes fluorescentes (Quadro 4) são sondas usadas na identificação de condições subcelulares, possibilitando a identificação de alterações estruturais ou metabólicas no interior da célula (BRAGA et al., 2016).
Quadro 4
Principais estruturas analisadas do espermatozóide e as sondas fluorescentes utilizadas.
Estrutura analisada |
Sonda fluorescente |
Avaliação da morfologia espermática |
Rosa bengala |
Avaliação da integridade da membrana plasmática |
Eosina e Nigrosina |
Avaliação de integridade de acrossoma |
Trypan blue e Giemsa |
Avaliação da integridade de DNA |
Alaranjado de acridine |
Teste de capacitação espermática |
Hidroclorito de clortetraciclina (CTC) |
Fonte: MARTINS et al., 2016.
A Citometria de Fluxo possibilita a contagem, classificação, exame e o isolamento dos espermatozoides bovinos, que são marcados com um corante fluorescente específico e movidos individualmente pelo sistema óptico do fluxo laminar para serem contados com maior repetibilidade e precisão (MAZIERO et al., 2009).
Esse feixe excita as sondas fluorescentes associadas às células e capta a frequência da luz e o equipamento converte essa frequência em sinais elétricos, que são quantificados pelo software. Por meio da Citometria de fluxo, é possível medir a quantidade de uma ou mais sondas fluorescentes associadas às células, de forma imparcial, com inigualável precisão, sensibilidade e rapidez (BERGSTEIN et al., 2014).
As sondas fluorescentes monitoram através da coloração a funcionalidade dos espermatozóides, avaliando a integridade da membrana plasmática e acrossomal, o potencial mitocondrial, a translocação de fosfolipídios de membrana, o índice de caspase-ativada, o índice de fragmentação de DNA, a integridade do flagelo, a peroxidação lipídica, a fosforilização da tirosina e a reação acrossomica (MAZIERO et al., 2009; ARRUDA et al., 2011; BERGSTEIN et al., 2014).
A Membrana plasmática é uma estrutura íntegra com funções essenciais à fecundação e a viabilidade seminal, garantindo a homeostase celular e mantendo a motilidade espermática (ARRUDA et al., 2011). A Capacitação espermática são mudanças sofridas pelo espermatozóide no trato reprodutivo da fêmea, ente elas a reação acrossomal, iniciada imediatamente após a ligação do espermatozóide à zona pelúcida (BERGSTEIN et al., 2014). A relação do potencial mitocondrial e a fertilidade ainda são desconhecidas, por isso, as sondas fluorescentes usadas na identificação do potencial mitocondrial são consideradas uma boa técnica de avaliação do sêmen (BERGSTEIN et al., 2014; CELEGHINI et al., 2017). Em testes de motilidade e integridade de membrana, espermatozóides com DNA lesionados podem ser considerados normais, entretanto, eles podem induzir a uma falha no desenvolvimento embrionário (LASCARRO e SIERRA, 2013).
Técnicas de associação de sondas fluorescentes estão sendo desenvolvidas para avaliação dos espermatozóides de diferentes espécies animais e dependendo do tipo de laser, dos detectores de radiação e dos filtros presentes no Citômetro é possível avaliar múltiplos parâmetros em uma única amostra (MAZIERO et al., 2009).
Após o presente estudo entende-se que é fundamental o uso de métodos adequados de coleta, armazenamento e de criopreservação do sêmen bovino, para garantir a qualidade e obter maiores índices de fertilidade nos rebanhos.
Para que a criopreservação ocorra de forma eficiente é necessário que a diluição seja realizada de forma correta, o que resultará num sêmen de melhor qualidade e na maior quantidade de doses inseminantes, permitindo a inseminação de maior número de fêmeas, proporcionando o melhoramento genético e tornando o processo mais lucrativo.
Utilizar sêmen com qualidade é imprescindível para a fertilidade e sucesso da reprodução de bovinos.
ABUD, C. O. G.; ABUD, L. J.; OLIVEIRA NETO, J. C.; DODE, M. A. N.; SERENO, J. R. B.; MARTINS, C. F. Comparação entre os sistemas automatizado e convencional de criopreservação de sêmen bovino. Ciênc. anim. bras., Goiânia-GO, v. 15, n. 1, p. 32-37, mar. 2014.
ARAUJO, G. F. de. Viabilidade da Dose Fracionada de Sêmen Bovino Criopreservado Descongelado por Diferentes Métodos. 2010. 40f. Dissertação (Mestrado em Ciência Animal) - Programa de Pós-Graduação em Ciência Animal do Núcleo de Ciências Agrarias e Desenvolvimento Rural da Universidade Federal do Pará. Belém-PA, Brasil.
ARRUDA, R. P. de; CELEGHINI, E. C. C.; GARCIA, A. R.; SANTOS, G. de C. dos; LEITE, T. G.; OLIVEIRA, L. Z.; LANÇONI, R.; RODRIGUES, M. de P. Morfologia espermática de touros: interpretação e impacto na fertilidade. Rev. Bras. Reprod. Anim., Belo Horizonte-MG, v.39, n.1, p.47-60, jan./mar. 2015.
ARRUDA, R. P.; CELEGHINI, E. C. C.; ALONSO, M. A.; CARVALHO, H. F.; OLIVEIRA, L. Z.; NASCIMENTO, J.; SILVA, D. F.; AFFONSO, F. J.; LEMES, K. M.; JAIMES, J. D. Métodos de avaliação da morfologia e função espermática: momento atual e desafios futuros. Rev. Bras. Reprod. Anim., Belo Horizonte-MG, v.35, n.2, p.145-151, abr./jun. 2011.
ASSUMPÇÃO, T. I. de; SOUZA, M. de A.; ALBERTON, C.; PALLAORO, R.; KITAGAWA, C.; SILVA, N. A. M. Características reprodutivas de machos bovinos da raça Nelore da fase pré-púbere à maturidade sexual. R. bras. Ci. Vet., Niterói-RJ, v. 20, n. 3, p. 148-154, jul./set. 2013. (A)
ASSUMPÇÃO, T. I. de; YONEYAMA, K. A. G.; PALLAORO, R.; KITAGAWA, C; ALBERTON, C. Perfil de Proteínas e Açúcares do Plasma Seminal e sua Relação com os Parâmetros Andrológicos de Touros da Raça Nelore. Biosci. J., Uberlândia-MG, v. 29, n. 4, p. 940-945, jul./ago. 2013. (B)
BARBOSA, L. M.; KANAZAWA, M. Y.; PERES, A. R.; SOUZA, F. F. de. Viabilidade do sêmen congelado obtido do epidídimo de touros post-mortem. R. bras. Ci. Vet., Niterói-RJ, v. 19, n. 3, p. 190-194, set./dez. 2012.
BERBER, R. C. A. Coleta e processamento de sêmen bovino. 2009
BERGSTEIN, T.G.; WEISS, R.R.; BICUDO, S.D. Técnicas de análise de sêmen. Rev. Bras. Reprod. Anim., Belo Horizonte-MG, v.38, n.4, p.189-194, out./dez. 2014.
BERTOL, M. A. F.; WEISS, R. R.; FUJITA, A. S.; KOZICKI, L. E.; ABREU, A. C. M. R. de; PEREIRA, J. F. S. Dois diluentes comerciais na criopreservação de espermatozóides do epidídimo de touros. Ciência Rural, Santa Maria-RS, v.44, n.9, p.1658-1663, set. 2014.
BORGES-SILVA, J. C.; SILVA, M. R.; MARINHO, D. B.; NOGUEIRA, E.; SAMPAIO, D. C.; OLIVEIRA, L. O. F.; ABREU, U. G. P.; MOURÃO, G. B.; SARTORI, R. Cooled semen for fixed-time artificial insemination in beef cattle. Reproduction, Fertility and Development, Austrália, v.28, n.7, p.1004-1008, jan. 2015.
BOSCARATO, A. G.; MARTINS, L. F. Uso de colesterol na criopreservação espermática e fertilidade: uma revisão. Arq. Ciênc. Vet. Zool. UNIPAR, Umuarama-PR, v. 17, n. 2, p. 143-148, abr./jun. 2014.
BOSCARATO, A. G.; MARTINS, L. F.; PINHO, R. O.; SILVA, Y. F. R. S.; PAPA, F. O.; MACEDO, G. G. Efeito da adição de ciclodextrina carregada com colesterol sobre a qualidade do sêmen congelado/descongelado de touros adultos da raça Nelore. Rev. Bras. Reprod. Anim., Belo Horizonte-MG, v.40, n.3, p.105-110, jul./set. 2016.
BRAGA, K. M. da S.; PIMENTA, V. de S. C.; RODRIGUES, F. A.; SANTOS, T. P. dos; ARAÚJO, E. G. de. Citometria de fluxo: histórico, princípios básicos e aplicações em pesquisa. ENCICLOPÉDIA BIOSFERA, Goiânia-GO, v.13 n.23; p. 304-319, 2016.
CARREIRA, J. T. Qualidade espermática e danos de DNA em espermatozóides criopreservados de touros Nelore jovens, adultos e senis. 2012. 101f. Tese (Doutorado em Medicina Veterinária) - Universidade Estadual Paulista, Faculdade de Ciências Agrárias e Veterinárias, Jaboticabal - SP, Brasil.
CARVALHO, F. H. de. Manejo geral de bovinos de corte, reprodução de bovinos e clínica médica de ruminantes. 2014. 52f. TCC (Graduação em Medicina Veterinária) - Universidade Federal do Paraná, Palotina-PR, Brasil.
CARVALHO, J. de O.; SARTORI, R.; LEMES, A. P.; MOURÃO, G. B.; DODE, M. A. N. Cinética de espermatozóides criopreservados de bovinos após sexagem por citometria de fluxo. Pesq. agropec. bras., Brasília-DF, v.44, n.10, p.1346-1351, out. 2009.
CAVALERO, T. S.; REIS, J. R.; JACOMINI, J. O. Morfologia espermática de touros nelore, pantaneiro e curraleiro avaliada de amostras coletadas diretamente dos testículos e dos epidídimos. Horizonte Científico, Uberlândia-MG, v.9, n.2, 24p. dez. 2015.
CELEGHINI, E. C. C.; ARRUDA, R. P. de; FLOREZ-RODRIGUEZ, S. A.; SANTOS, F. B. dos; ALVES, M. B. R.; OLIVEIRA, B. M. M. de. Impacto da qualidade do sêmen sobre a fertilidade a campo em bovinos. Rev. Bras. Reprod. Anim., Belo Horizonte-MG, v.41, n.1, p.40-45, jan./mar. 2017.
CHACUR, M. G. M.; DIAS, H. S. D.; PAPA, F. O.; LOUVISON, B. A.; CALESCO, M. M.; PAPA, P. de M. Efeito de meios diluentes na viabilidade de sêmen congelado bovino. Vet. e Zootec., Botucatu-SP, v.19, n.1, p.346-355, mar. 2012.
COSTA E SILVA, E. V.; FERREIRA, B. X.; QUEIROZ, V. L. D.; COSTA FILHO, L. C. C.; ZÚCCARI, C. E. S. N. Precocidade sexual de touros a campo em condições tropicais. Rev. Bras. Reprod. Anim., Belo Horizonte-MG, v.37, n.2, p.97-104, abr./jun. 2013.
CRESPILHO, A. M. Efeito do meio diluidor e da dose inseminante sobre a congelabilidade e fertilidade do sêmen bovino utilizado em programas de inseminação artificial em tempo-fixo (IATF). 2007. 124f. Dissertação (Mestrado em Medicina Veterinária) – Universidade Estadual Paulista, Faculdade de Medicina Veterinária e Zootecnia, Botucatu – SP, Brasil.
DIAS, F. E. F.; NUNES, C. M.; CAVALCANTE, T. V.; SANTOS, H. D.; MINHARRO, S.; GARCIA, J. F. PCR Multiplex fluorescente para detecção de bactérias em sêmen bovino. Pesqui. Vet. Bras., Rio de Janeiro-RJ, v.32, n.3, p. 211-216, mar. 2012.
DIAS, H. S. Efeito de meios diluentes sobre a viabilidade de sêmen congelado bovino. 2010. 58f. Dissertação (Mestrado em Ciência Animal) - Universidade do Oeste Paulista, UNOESTE: Presidente Prudente-SP, Brasil.
DUARTE JÚNIOR, M. F.; ZERVOUDAKIS, L. K. H.; ZERVOUDAKIS, J. T.; NICHI, M.; BERTOLLA, R. P.; TSUNEDA, P. P.; SENRA E SILVA, L. E.; WINGERT, F. M.; MARINHO, W. A. dos S. Avaliação do tocoferol no congelamento do sêmen bovino e nas taxas de prenhez após inseminação artificial em tempo fixo. R. bras. Ci. Vet., Niterói-RJ, v. 22, n. 2, p. 114-118, abr./jun. 2015.
EMERICK, L. L.; DIAS, J. C.; VALE FILHO, V. R. do; SILVA, M. de A. e; ANDRADE, V. J. de; LEITE, T. G.; MARTINS, J. A. M. Avaliação da Integridade de Membrana em Espermatozoide Bovino Criopreservado para Prever o Índice de Prenhez. Ciên. Anim. Bras., Goiânia-GO, v.12, n.3, p. 536-546, jul./set. 2011.
FUJITA, A. S.; WEISS, R. R.; ROSSI JUNIOR, P.; KOZICKI, L. E.; GRESELLE, F. V. N.; BERTOL, M. A. F. Taxa de Gestação em Novilhas Nelore Sincronizadas para IATF e Inseminadas com Sêmen Resfriado e Congelado. Arch. Vet. Sci., Curitiba-PR, v.18, n.3, p.13-21, jul/set. 2013.
GARCIA, S. M. L. de; FERNÁNDEZ, C. G. Espermatogênese. In: Embriologia. 2ª ed. Porto Alegre: Artmed. 2001. Pg. 42-61.
GARNER, D. L.; HAFEZ, E. S. E. Espermatozóides e Plasma Seminal. In: HAFEZ, E. S. E.; HAFEZ, B. Reprodução Animal. 7ª ed. Barueri - SP: Manole, 2004, cap. 7, p. 97-110.
GUERRA NETO, J. de O.; CHACUR, M. G. M.; CALDATO, F. A.; SILVA, A. A. da; CASTILHO, C. Correlação da Morfologia Espermática em Programas de Inseminação Artificial Convencional em Novilhas e Vacas da Raça Nelore. Colloquium Agrariae, Presidente Prudente-SP, v. 8, n.2, p. 57-64 jul/dez. 2012.
GUYTON, A. C.; HALL, J. E. Funções Reprodutoras e Hormonais Masculinas (e Função da Glândula Pineal). In: Tratado de Fisiologia Médica. 10ª ed. Rio de Janeiro – RJ: Guanabara Koogan. 2002. Cap. 80, pg. 857-868.
HAFEZ, E. S. E. Preservação e Criopreservação de Gametas e Embriões. In: HAFEZ, E. S. E.; HAFEZ, B. Reprodução Animal. 7ª ed. Barueri - SP: Manole, 2004, cap. 30, p. 435-446.
LASCARRO, A. K. G.; SIERRA, J. D. P. Eficiencia comparativa entre dos diluyentes para la criopreservación de semen en toros Brahmán en el departamento de Antioquia. 2013. 70f. TCC (Graduação em Medicina Veterinária) - Facultad de Ciências Agropecuárias, Universidad De La Salle, Bogotá - Colômbia.
LEITE, P. A.; SCHREDERA, G. G.; ALMEIDA, C. L. R. de; ZÚCCARIA, C. E. S. N.; COSTA E SILVA, E. V. da. Criopreservação do Sêmen Bovino. UNOPAR Cient., Ciênc. biol. saúde, Londrina-PR, v.13, n.4, p. 279-286, mai. 2011.
LIMA, J. P. R. P. Avaliação da Criopreservação e posterior Capacidade Fecundante de Sémen de Touro da Raça Brava a partir da recolha Post-Mortem.2014. 74f. Dissertação (Mestrado em Engenharia Zootécnica) - Departamento de Ciências Agrárias, Engenharia Zootécnica Universidade dos Açores, Angra do Heroísmo - Portugal.
LUZ, H. K. M.; WANDERLEY, L. S.; FAUSTINO, L. R.; SILVA, C. M. G. da; FIGUEIREDO, J. R. de; RODRIGUES, A. P. R. Papel de agentes antioxidantes na criopreservação de células germinativas e embriões. Acta Scientiae Veterinariae, Porto Alegre-RS, v.39, n.2, p.1-13, 2011.
MADEIRA, E.M.; BIANCHI, I.; VIEIRA, M.B.; SCHNEIDER, A.; SEVERO, N.C.; PFEIFER, L.F.M.; CORRÊA, M.N. Avaliação de diferentes crioprotetores intra e extracelulares na criopreservação de sêmen de touros. Arq. Bras. Med. Vet. Zootec., Belo Horizonte-MG, v.65, n.2, p.415-420, abr. 2013.
MARQUES FILHO, W. C. et al. Avaliação do estresse em touros Nelore (Bos tauriis indicus) submetidos à eletroejaculação. Vet. e Zootec., Botucatu-SP, v.15, n.3, p. 531-541, dez. 2008.
MARQUES, M.; MENDES, R. Espermocitologia. Brasília, Curso de Farmácia Uni-Anhanguera. Disponível em < http://www.unianhanguera.edu.br >. Acesso em 20 de ago. de 2017.
MARTINS, C. F.; DODE, M. A. N.; SILVA, A. E. D.F. Atlas de morfologia espermática bovina. Brasília - DF: Embrapa, 2016. 100p.
MARTINS, L. F.; PINHO, R. O.; SIQUEIRA, J. B.; DOMENECK, F.; MIRANDA NETO, T.; GUIMARÃES, J. D. Avaliação da Qualidade do Sêmen Fresco de Touros Jovens da Raça composto Tropical Montana e suas Correlações com o Teste Hiposmótico. Acta Veterinaria Brasilica, Mossoró-RN, v.6, n.3, p.192-198, 2012.
MAZIERO, R. R. D.; CRESPILHO, A. M.; FREITAS-DELL’AQUA, C. de P.; DELL’AQUA JUNIOR, J. A.; PAPA, F. O. Análise de sêmen bovino e sua relação com a fertilidade. Rev. Bras. Reprod. Anim. Supl., Belo Horizonte-MG, n.6, p.5-10, dez. 2009.
MELLO, R. R. C. et. al. Puberdade e maturidade sexual em touros bovinos. ACSA – Agropecuária Científica no Semi-árido, Campus de Patos-PB, v.10, n.3, p. 11-28, jul/set. 2014.
MIRANDA NETO, T.; CASTILHO, E. F. de; PINHO, R. O.; GUIMARÃES, S. E. F.; COSTA, E. P. da; GUIMARÃES, J. D. Puberdade e maturidade sexual em touros jovens da raça Simental, criados sob regime extensivo em clima tropical. R. Bras. Zootec., Viçosa-MG, v.40, n.9, p.1917-1924, set. 2011.
MONTEIRO, F. M.; OLIVEIRA, L. Z.; OLIVEIRA, C. S.; TETZNER, T. A. D.; MERCADANTE, M. E. Z.; BRANCO, R. H.; GARCIA, J. M. Avaliação Andrológica de Touros Jovens de Diferentes Raças Selecionados para Peso Pós-Desmama. B. Indústr. anim., Nova Odessa, v.68, n.1, p. 037-043, jan/jun. 2011.
NASCIMENTO, P. S.; CHAVES, M. S.; SANTOS FILHO, A. S. dos; GUIDO, S. I.; GUERRA, M. M. P.; BARTOLOMEU, C. C. Produção In Vitro de Embriões Utilizando-se Sêmen Sexado de Touros 5/8 Girolando. Ciênc. anim. bras. Goiânia-GO, v.16, n.3, p. 358-368, jul/set. 2015.
OLIVEIRA, L. Z.; OLIVEIRA, C. S.; MONTEIRO, F. M.; LIMA, V. F. M. H. de; LIMA, F. M. de; COSTA, M. Z. Efeito da idade sobre as principais características andrológicas de touros Brangus – Ibagé criados extensivamente no estado do Mato Grosso do Sul – Brasil. Acta Scientiae Veterinariae, Porto Alegre-RS, v.39, n.1, pub. 946, 8p. jan/mar. 2011.
PAPA, F. O.; CRESPILHO, A. M.; FREITAS DELL`AQUA, C. P.; DELL `AQUA JR, J. A. Impacto do sêmen no sucesso dos programas de IATF: métodos básicos e avançados de avaliação. Biotecnologia da Reprodução em Bovinos. Anais... In: 3º Simpósio Internacional de Reprodução Animal Aplicada. Londrina – PR, 2008.
PRADO, R. B.; KOIVISTO, M. B.; CARREIRA, J. T.; PERRI, S. H. V.; RODRIGUES, L. H.; ATIQUE NETTO, H.; TORREGROSSA, T. L. G.; VICENTE, W. R. R.; FELICIANO, M. A. R. Efeito da utilização de diferentes diluidores para a produção in vitro de embriões bovinos. Arq. Bras. Med. Vet. Zootec., Belo Horizonte-MG, v.64, n.5, p.1118-1126, mai. 2012.
QUEIROZ, V. L. D.; COSTA FILHO, L. C. C. da; ROSA, L. da S.; ZÚCCARI, C. E. S. N.; COSTA e SILVA, E. V. Sazonalidade na congelabilidade de sêmen bovino. Arq. Ciênc. Vet. Zool. UNIPAR, Umuarama-PR, v.18, n.1, p. 39-47, jan./mar. 2015.
REECE, W. O. Reprodução de Machos. In: Anatomia Funcional e Fisiologia dos Animais Domésticos. 3ª ed. São Paulo: Roca, 2014, cap.13, p.358-380.
SEVERO, N. C. Influência da qualidade do sêmen bovino congelado sobre a fertilidade. A Hora Veterinária, Porto Alegre-RS, v.28, n.167, p. 36-39, jan/fev. 2009.
SILVA, A. E. D. F.; DIAS, A. L.; UNANIAN, M. M.; FREITAS, A. R. de; BLOCH JUNIOR, C. Conteúdo de Peptídeos e Avaliação Morfofisiológica dos Espermatozóides do Epidídimo e Ejaculado de Bovinos. R. Bras. Zootec., Viçosa-MG, v.32, n.6, p.1890-1900, jun. 2003 (Supl. 2).
SIQUEIRA, J. B.; GUIMARÃES, J. D.; COSTA, E. P. da; HENRY, M.; TORRES, C. A. A.; SILVA, M. V. G. da; SILVEIRA, T. da S. Relação da taxa de gestação com sêmen bovino congelado e testes de avaliação espermática in vitro. R. Bras. Zootec., Viçosa-MG, v.36, n.2, p.387-395, fev. 2007.
TEIXEIRA, L. V. Estudo da Coleta e Processamento de Sêmen Bovino. 2009. 37f. Monografia (TCC de Medicina Veterinária) - Centro Universitário das Faculdades Metropolitanas Unidas - FMU, São Paulo – SP, Brasil.
VASCONCELOS FILHO, W. F. de. Eficiência da congelação automatizada na viabilidade de sêmen bovino. 2010. 58f. Dissertação (Mestrado em Zootecnia) - Universidade Federal Rural do Rio de Janeiro Instituto de Zootecnia, Seropédica – RJ, Brasil.
1. Discente do Programa de Pós-Graduação Stricto Sensu Mestrado em Desenvolvimento Rural Sustentável. Universidade Estadual de Goiás, São Luís de Montes Belos, Goiás, Brasil. e-mail de contato: jaquelinefds12@gmail.com
2. Docente do Programa de Pós-Graduação Stricto Sensu Mestrado em Desenvolvimento Rural Sustentável. Universidade Estadual de Goiás, São Luís de Montes Belos, Goiás, Brasil. e-mail de contato: klayto.santos@ueg.br
3. Docente do Programa de Pós-Graduação Stricto Sensu Mestrado em Desenvolvimento Rural Sustentável. Universidade Estadual de Goiás, São Luís de Montes Belos, Goiás, Brasil. e-mail de contato: aracele.pales@ueg.br
4. Docente do Programa de Pós-Graduação Stricto Sensu Mestrado em Desenvolvimento Rural Sustentável. Universidade Estadual de Goiás, São Luís de Montes Belos, Goiás, Brasil. e-mail de contato: clarice.backes@ueg.br
5. Docente do Programa de Pós-Graduação Stricto Sensu Mestrado em Desenvolvimento Rural Sustentável. Universidade Estadual de Goiás, São Luís de Montes Belos, Goiás, Brasil. e-mail de contato: diogo.ferro@ueg.br
6. Docente do Programa de Pós-Graduação Stricto Sensu Mestrado em Desenvolvimento Rural Sustentável. Universidade Estadual de Goiás, São Luís de Montes Belos, Goiás, Brasil. e-mail de contato: rafael.ferro@ueg.br
7. Discente do Programa de Pós-Graduação Stricto Sensu Mestrado em Desenvolvimento Rural Sustentável. Universidade Estadual de Goiás, São Luís de Montes Belos, Goiás, Brasil. e-mail de contato: patriciafpeixer@gmail.com