

Vol. 38 (Nº 47) Ano 2017. Pág. 12
Ecléia Alexandra Poltronieri Buda SALLES 1; Giovana Bomfim de ALCANTARA 2; Marguerite Germaine Ghislaine QUOIRIN 3; Antonio Natal GONÇALVES 4; Antonio Rioyei HIGA 5
Recebido: 26/05/2017 • Aprovado: 23/06/2017
RESUMO: O objetivo deste trabalho foi avaliar tipos e concentrações de reguladores vegetais na multiplicação in vitro e duas classes de tamanho das mudas na aclimatização de acácia-negra. O tratamento com 8,8 e 4,4 µM de BAP apresentou as melhores taxas de multiplicação. O subcultivo com 2 g L-1 de carvão ativado promove multiplicação, alongamento das brotações e enraizamento. A taxa de sobrevivência foi maior que 90%, aos 150 dias no viveiro, independente do tamanho de muda testado. |
ABSTRACT: This study aimed to test types and concentrations of growth regulator for the in vitro multiplication and two classes of seedling size were also tested in acclimatization of seedlings of black wattle. The best multiplication rates resulted from the treatments with 8.8 and 4.4 µM BAP. Activated charcoal promoted shoot and root growth. More than 90% of the seedlings survived after acclimatization of micropropagated plants by direct transfer to the green house, regardless of cutting size. |
Acacia mearnsii De Wild., popularmente conhecida como acácia negra, pertencente a família Fabaceae é natural do sudeste da Austrália. Apresenta grande potencial econômico, principalmente no estado do Rio Grande do Sul. É uma espécie promissora em sistemas agroflorestais, cuja madeira é utilizada como matéria-prima na indústria de papel, celulose, compensada (Roversi et al., 2002) e carvão. Da casca é retirado tanino utilizado em diversos setores industriais (ABRAF, 2013, 149 p.).
Para o melhoramento genético da espécie, cruzamentos controlados são realizados para obtenção de sementes de indivíduos/ famílias superiores. O percentual de inflorescência que formam vagem nestes cruzamentos de polinização controlada é baixo, em média 12% (Paula, 2005), o que representa um problema, pois essa técnica envolve custos com equipe treinada, equipamentos e tempo. A micropropagação pode ser utilizada para produção/ multiplicação massal de plântulas provenientes destas sementes, pois é uma técnica que exige pequeno espaço físico, produz mudas livres de doenças e a taxa de multiplicação é superior a da estaquia convencional (George et al., 2008, 501 p.). As espécies lenhosas apresentam dificuldades para o estabelecimento in vitro, principalmente se for utilizado material proveniente de plantas adultas, pois podem apresentar infestação interna ou externa por microrganismos (Couto et al., 2004). Por isso, a utilização de plântulas germinadas in vitro, em condições assépticas, torna-se mais vantajosa (Skirvin, 1981).
A indução e expressão das possíveis respostas morfogênicas em culturas de células, tecidos e órgãos in vitro, são dependentes de fatores externos, químicos e físicos, como meio de cultura, reguladores de crescimento e condições ambientais, e também de fatores inerentes ao material vegetal, como fatores hereditários, estado fisiológico do explante e da planta que lhe deu origem. Dos fatores externos, pode-se destacar a utilização dos reguladores de crescimento como as citocininas e auxinas (Kerbauy, 2004, 452 p.; George et al., 2008, 501 p.).
As citocininas constituem o grupo de fitorreguladores indispensável para a quebra da dominância apical e indução de proliferação de gemas axilares; o tipo e a concentração das mesmas são os fatores que mais influenciam o sucesso da multiplicação in vitro. Entre as citocininas naturais encontram-se a zeatina (ZEA) e 2-isopenteniladenina (2iP) enquanto que as sintéticas destacam-se a cinetina (CIN), 6-benzilaminopurina (BAP) e thidiazuron (TDZ). As citocininas promovem divisão, alongamento e diferenciação celular e retardam a senescência das plantas. As citocininas promovem produção de partes aéreas, mas seu excesso pode ser tóxico e levar ao encurtamento dos entrenós e a problemas na fase de enraizamento. Outros efeitos residuais atribuídos a citocininas têm sido observados nas plantas após o transplantio. Menor capacidade de sobrevivência, quebra da dominância apical, deformação de frutos e manutenção de um hábito arbustivo são algumas dessas características (George et al., 2008, 501 p.).
Várias citocininas têm sido descritas para regeneração e indução de múltiplas brotações para espécies de Acacia. A micropropagação de acácia negra tem sua problemática na definição do meio básico a ser utilizado e do balanço adequado entre auxinas e citocininas, principalmente na etapa de multiplicação de gemas (Disarz, Corder, 2009). O BAP tem sido muito utilizado por diversos autores para promover a multiplicação da parte aérea e surgimento de gemas adventícias, em diversas espécies.
As auxinas, outro grupo de reguladores de crescimento fundamentais na indução da divisão celular e diferenciação de raízes, muitas vezes utilizadas nas fases de multiplicação para favorecer o crescimento das culturas (Mantovani et al., 2001). As giberelinas afetam vários aspectos do crescimento e desenvolvimento vegetal, mas são mais conhecidas pelo efeito no alongamento dos entrenós de algumas plantas (Taiz, Zeiger, 2009, 848 p.). O ácido giberélico (GA3) é a giberelina mais utilizada na micropropagação. A adição de GA3 no meio de cultura pode auxiliar no crescimento e desenvolvimento da parte aérea, diminuir ou impedir a formação de raízes adventícias, brotos ou embriões somáticos. Na fase de alongamento, tratamento com GA3 pode ser benéfico quando as brotações formadas são muito pequenas (George et al., 2008, 501 p.).
A aclimatização representa uma etapa importante e em alguns casos, chega a ser o fator limitante no processo de micropropagação e produção de mudas. Fatores como genótipo, estresse hídrico, alteração do metabolismo heterotrófico (in vitro) para autotrófico, infecção por patógenos e estresse pela luz, além das variações de temperatura, interferem no sucesso da aclimatização (George et al., 2008, 501 p.).
O presente trabalho teve como objetivo avaliar os efeitos de reguladores vegetais na multiplicação de mudas germinadas in vitro, alongamento e aclimatização ex vitro das plantas micropropagadas. Para isto foram avaliados os efeitos de diferentes concentrações de 6-benzilaminopurina (BAP), cinetina, thidiazuron (TDZ), ácido giberélico (GA3) e combinações de BAP com GA3 para multiplicação e alongamento de segmentos nodais de Acacia mearnsii e testou-se a influência do tamanho das mudas micropropagadas na aclimatização/rustificação ex vitro.
Os ensaios foram realizados no Laboratório de Genética e Melhoramento Florestal da Universidade Federal do Paraná. Sementes germinadas in vitro são procedentes da área de produção de sementes da empresa TANAGRO S.A. A quebra de dormência das sementes foi realizada com água fervente por um minuto, seguido de imersão em hipoclorito de sódio a 2% (v/v), sob agitação por 10 minutos, e finalmente três enxagues em água destilada e esterilizada, na qual permaneceram por aproximadamente uma hora, até a inoculação em meio de cultura. Foram utilizados como explantes segmentos nodais obtidos de plântulas de 40 dias, com 1 ± 0,3 cm de tamanho, contendo apenas uma gema axilar.
Os explantes foram introduzidos em tubos de ensaio de vidro, de 2 cm de diâmetro por 15 cm de altura, com tampa de polietileno, com 10 ml de meio de cultura. O meio de cultura utilizado em todas as etapas foi o MS (Murashige, Skoog, 1962), com sais reduzidos a ¾, vitaminas completas, 30 g L-1 de sacarose, pH ajustado a 5,8 ± 2, solidificado com 7,5 g L-1 de ágar bacteriológico (Himedia®). A autoclavagem foi realizada a 121°C e com 1,1 Kgf/cm² de pressão por 20 minutos. As culturas foram mantidas em temperatura de 26 ±2°C, sob lâmpadas fluorescentes de 30W, gerando luminosidade média de 2800 lux e fotoperíodo de 16 horas. Antes da autoclavagem, foram adicionados ao meio de cultura, reguladores vegetais (BAP, cinetina, giberelina ou TDZ) e/ou 2 g L-1 de carvão ativado (Tabela 1).
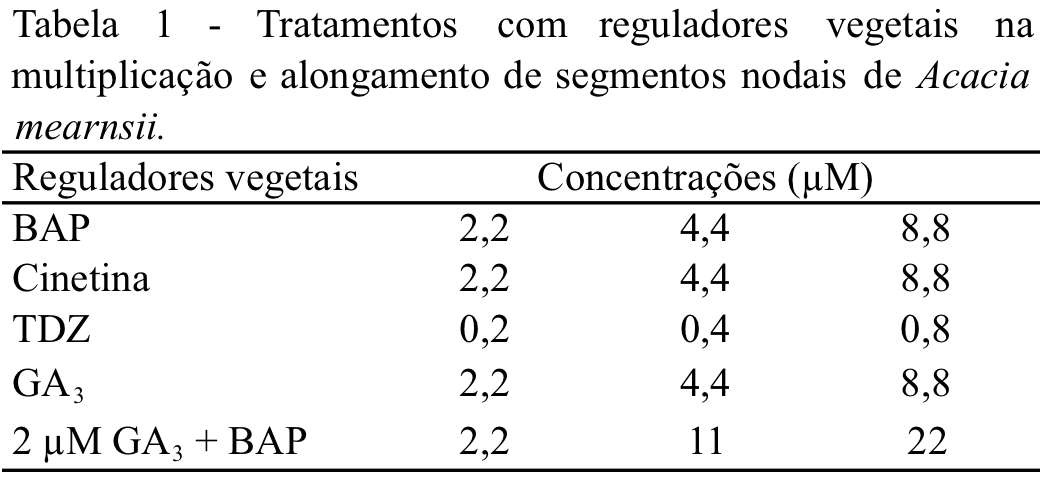
O delineamento utilizado foi de blocos ao acaso (DBC) com 5 blocos e 8 plantas por parcelas (40 plantas por tratamento). O número de tratamentos (concentrações de reguladores vegetais) variou de 4 a 7. As avaliações foram realizadas aos 30, 45 e 60 dias de cultura, quando avaliou-se o número médio de gemas, número médio de brotações, comprimento dos brotações (cm), porcentagem de calos e enraizamento.
Cada experimento foi submetido a um teste de homogeneidade das variâncias (Levene), análise de variância (ANOVA, p<0,05 e p<0,01) e teste de médias, Bonferroni ou Tukey a 5% de probabilidade, usando programa IBM SPSS Statistic19®. A variável não homogênea foi submetida a transformação por meio da raiz quadrada de (x+0,5), sendo x a variável medida no experimento. No experimento que recebeu BAP e depois carvão ativado foi realizado o Teste T de Student, no programa IBM SPSS Statistic 19®.
Segmentos nodais de 1 cm de comprimento foram inoculados em meio MS suplementado com diferentes concentrações de BAP (0; 2,2; 4,4 e 8,8 µM). Após 45 dias, foram transferidas para MS ¾ de sais, vitaminas, inositol e sacarose, suplementado com 2 mg L-1 de carvão ativado, por mais 45 dias. Este material vegetal multiplicado e alongado foi utilizado nos experimentos com cinetina, TDZ e BAP associado com GA3.
Segmentos nodais de aproximadamente 1 cm, provenientes do subcultivo em meio MS ¾ de sais e adição de 2 g L-1 de carvão ativado, foram divididos e transferidos para tubos de ensaio com 10 ml de MS ¾ de sais, suplementado com diferentes concentrações de cinetina (0; 2,2; 4,4 e 8,8 µM) ou TDZ (0; 0,2; 0,4 e 0,8 µM).
Adicionou-se no meio de cultura 2 µM de giberelina e diferentes concentrações de BAP (0; 2,2; 11; 22 µM). Os explantes provenientes de segmentos nodais de 1 cm foram inoculados em tubos de ensaio contendo 10 ml de meio de cultura e avaliados após 30 dias de subcultivo.
Segmentos nodais de 1 cm de comprimento foram inoculados em tubos de ensaio contendo 10 ml de meio nutritivo suplementado com giberelina (GA3) sendo as concentrações de 2,2; 4,4; 8,8 µM. Após 30 dias, foi realizada a avaliação do comprimento, presença de raiz, calo, número de gemas e brotos. As plântulas provenientes dos testes de multiplicação e alongamento foram subcultivadas em meio contendo 2 g L-1 de carvão ativado, por no mínimo 40 dias, antes de serem encaminhadas para aclimatização.
Para aclimatização, mudas micropropagadas e provenientes de vários subcultivos, foram separadas em duas classes de altura: 2 a 4,9 cm e 5 a 8 cm. Para padronização das mudas foram cortadas cerca de 80% do volume de raízes e folhas de cada indivíduo. As mudas foram plantadas em bandejas de plástico medindo 55 cm de comprimento, 28 cm largura e 5,5 cm de altura, com substrato a base de vermiculita, por 20 dias até serem transferidas para tubetes de 280 cm³, com substrato a base de casca de pinus marca comercial Plantmax®. As mudas permaneceram em casa de enraizamento, com cobertura de plástico transparente, luz natural e temperatura de 27 ± 3°C, umidade constante de 92% ± 3% por mais três semanas, totalizando 40 dias. Foram transferidas para casa de sombra, com sombrite de 50%, temperatura média de 22°C e irrigadas por 10 minutos duas vezes ao dia, por uma semana. Após este período, foram levadas para área de rustificação do viveiro, no qual receberam irrigação duas vezes ao dia por 15 minutos a pleno sol. Todas as mudas foram fertirrigadas duas vezes por semana, a partir do segundo dia da instalação do experimento. As avaliações de sobrevivência foram realizadas mensalmente e as alturas foram medidas aos 90,120 e 150 dias da instalação.
As sementes apresentaram alta taxa de germinação (em média 90%), com plântulas de aspecto normal. A taxa de contaminação por fungos ou bactéria foi baixa (2%).
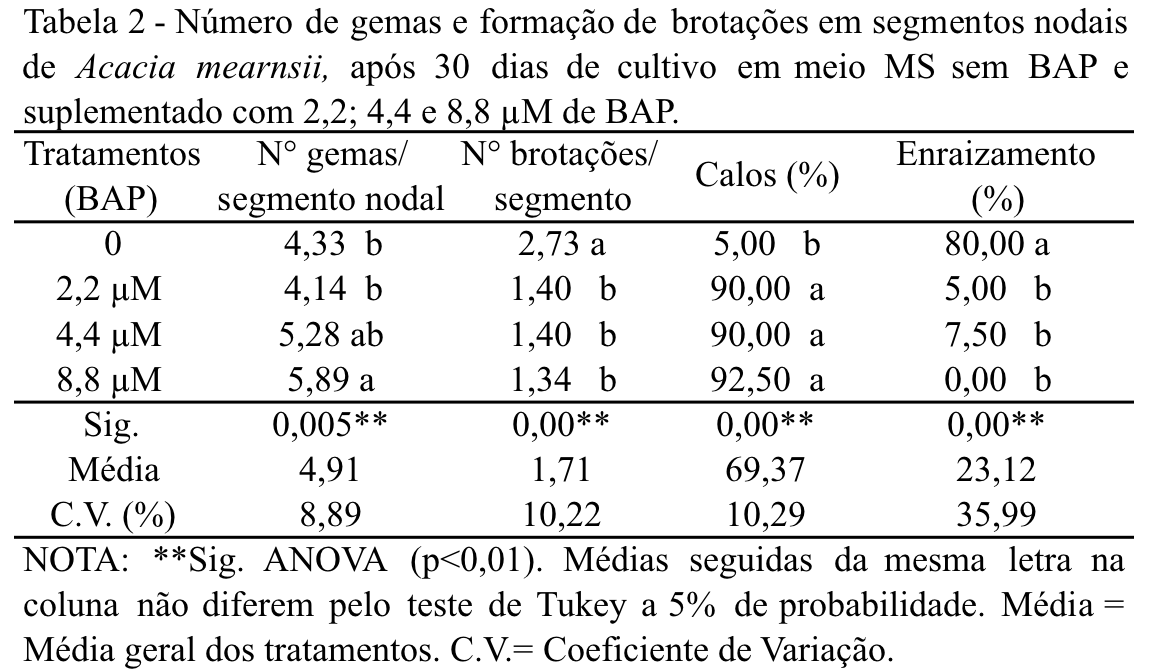
As concentrações de 4,4 e 8,8 µM de BAP, diferiram estatisticamente dos outros tratamentos para número de gemas formadas por segmento nodal, após 30 dias (Tabela 2). Resultados semelhantes foram encontrados por Borges Júnior, Soborsa e Martins-Corder (2004), que relatam que a maior taxa de multiplicação de gemas (3,1 gemas/ explante) para Acacia mearnsii foi obtida com 8,8 µM de BAP em meio de cultura B5. Correia e Graça (1995) obtiveram maior proliferação de brotações de Acacia mearnsii (3,5 brotações/explante) com a suplementação de 13,32 µM de BAP e 0,25 µM de AIB em meio MS.
Para número de brotos por segmento nodal, o melhor tratamento foi o sem BAP, pois apesar de grande quantidade de gemas formadas no tratamento com BAP, estas estavam aglomeradas, dificultando a divisão em novas plantas. Resultados semelhantes foram obtidos por Mantovani et al. (1999) com Didymopanax morototoni, que relataram que a alta concentração de BAP (de 4,44 a 44,38 µM) em meio WPM, provocou a formação de brotações atípicas, com entrenós curtos e folhas curvadas, espessas, quebradiças e de tamanho reduzido. Estes sintomas são provocados por desordens fisiológicas que ocorrem frequentemente na cultura in vitro de muitas espécies, e são atribuídas principalmente ao excesso de citocininas nos meios de cultura (Ziv, 1991).
Todas as concentrações de BAP utilizadas promoveram o desenvolvimento de calos na base do explante, o que não é desejável. A testemunha foi a que apresentou menor taxa de calogênese. Os calos apresentaram maiores dimensões principalmente nos tratamentos com concentrações elevadas de BAP. Foi verificada boa formação de gemas (4,33/explante) mesmo sem adição de reguladores vegetais no meio (Tabela 2).
A maior porcentagem de enraizamento (80,0%) foi verificada no tratamento sem BAP (Tabela 2). Esse resultado indica a presença de auxina endógena que estaria favorecendo o enraizamento. Nos demais tratamentos, a porcentagem de enraizamento vai diminuindo em função do balanço auxina/ citocinina que está sendo alterada pela BAP adicionada no meio de cultura.
Para número de brotos por segmento nodal, calos e enraizamento, os resultados indicam que o BAP influenciou negativamente estas três variáveis mensuradas (Tabela 2). Mas, vários autores testando reguladores vegetais com Acacia, recomendam o uso de BAP na etapa de multiplicação. Para a multiplicação de segmentos nodais de Acacia nilotica subespécie indica, recomendam o uso de 6,6 µM de BAP em meio B5, obtendo-se 6,3 brotações/segmento nodal (Dewan, Nanda, Shrish, 1992). Para Acacia catechu cultivada em MS com 6,6 µM de BAP e 6,97 µM de cinetina obtiveram 12 brotações/ explante (Kaur, Kant, 2000). Foram observadas maior porcentagem de brotações para segmentos nodais coletados de árvores adultas de Acacia auriculiformis em MS adicionado de 8,8 µM de BAP e 0,54 µM de ANA (Girijashankar, 2011). Porém Quoirin et al. (2001) relataram que a adição de 8,87 µM de BA e/ou 1,44 ou 2,88 µM de GA3 não influenciou significativamente a multiplicação de segmentos nodais de Acacia mearnsii em meio MS ¾.
Após 45 dias, os explantes foram transferidos para meio de cultura com carvão ativado para promover o alongamento das brotações. Não houve diferença significativa entre os tratamentos, o que demonstra que o carvão ativado pode ter adsorvido o BAP do meio de cultura, pois a tendência de aumento no número de gemas não se manteve com a maior concentração de BAP. Observou o alongamento e produção de uma a duas gemas, as outras permaneceram aglomeradas e, com o passar dos dias, começaram a apresentar clorose. Comparando os explantes antes, no tratamento com diferentes concentrações de BAP e depois em meio com carvão ativado, para variável número de gemas, o carvão ativado apresentou influência positiva na formação de gemas (Tabela 3).
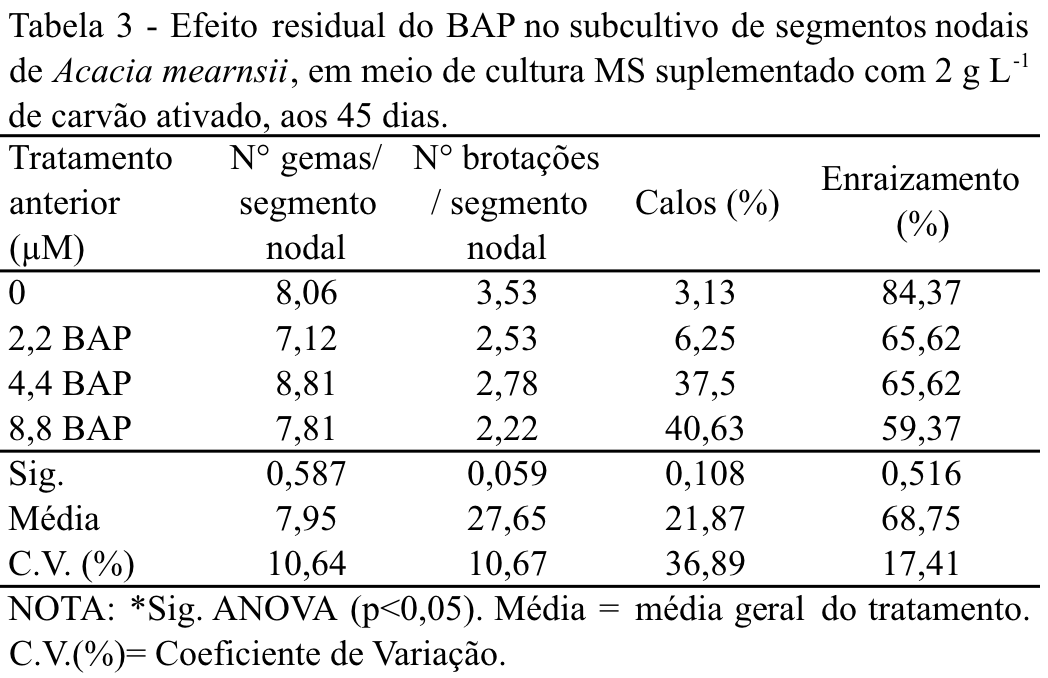
Quando o carvão ativado foi adicionado ao meio de cultura, apesar de não haver diferença significativa entre os tratamentos (Tabela 3), os explantes provenientes do tratamento com 4,4 µM de BAP produziram maior número de gemas (8,81/segmento nodal). Resultados semelhantes foram encontrados em outros trabalhos com o uso de carvão ativado para alongamento das brotações. Quoirin et al. (2001), relatam que adição de 2 g L-1 de carvão ativado no meio de cultura MS ¾ promoveu alongamento das brotações e diminuiu a clorose das folhas na fase de multiplicação de A. mearnsii. A multiplicação, o crescimento e a qualidade das brotações de Didymopanax morototoni nos tratamentos contendo reguladores de crescimento foram inferiores àqueles observados no tratamento contendo apenas carvão ativado adicionado ao meio WPM (Mantovani et al., 1999).
Pode-se observar também, que na presença do carvão ativado o número de gemas, número de brotos e porcentagem de enraizamento foram maiores em relação ao tratamento com BAP e houve diminuição na porcentagem de calos formados, o que é desejável. Portanto, a presença de carvão ativado no meio MS ¾ de sais influenciou positivamente na micropropagação de A. mearnsii.
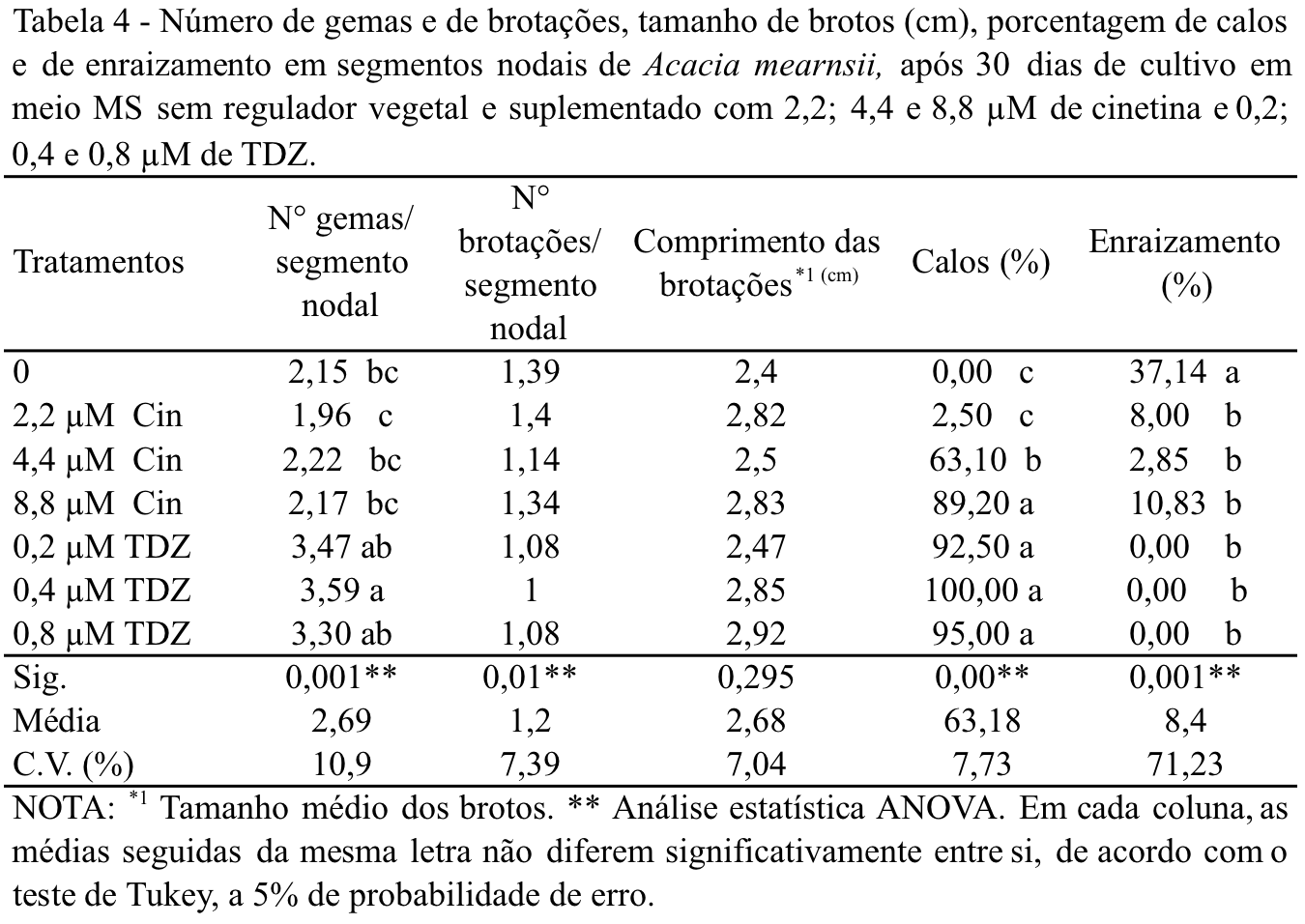
Após 30 dias de cultivo, o desenvolvimento de gemas axilares, calos e raízes foi influenciado pela presença de citocininas. Houve diferença significativa entre os tratamentos, para as variáveis número de gemas, porcentagem de calos e enraizamento. Para a variável número de gemas por segmento nodal, o tratamento com 0,4 µM de TDZ foi superior aos tratamentos com cinetina, mas não diferiu estatisticamente dos tratamentos com 0,2 e 0,8 µM de TDZ. A testemunha não diferiu estatisticamente dos tratamentos com cinetina, mas houve diferença entre os tratamentos com TDZ para quantidade de gemas formadas por segmento nodal (Tabela 4).
O TDZ, quando comparado com a cinetina proporcionou maior taxa de multiplicação, ou seja, maior número de gemas formadas por segmento nodal, sendo o tratamento com 0,4 µM de TDZ superior aos demais, porém não diferiu estatisticamente dos tratamentos com 0,2 e 0,8 µM de TDZ. Para número de brotações/ segmento nodal e tamanho médio das brotações, não houve diferença estatística entre a testemunha e os tratamentos com TDZ e cinetina (Tabela 4). A aplicação de reguladores vegetais em tecidos jovens de Acacia mearnsii e cotilédones cultivados na presença de 2,33 a 9,30 µM de cinetina ou 1,82 µM de TDZ e 2,69 µM de ácido naftalenoacético (ANA), em meio MS diluído pela metade, também proporcionou as melhores taxas de regeneração de gemas (Quoirin et al., 1998). Para segmentos nodais de Annona glabra, cultivados em WPM, na presença de BAP, TDZ, cinetina ou zeatina (ZEA), o melhor tratamento para multiplicação foi com 4,65 µM de cinetina e 4,4 µM de BAP (Oliveira et al., 2010). Para multiplicação de gemas axilares induzidas em segmentos nodais de louro-pardo (Cordia trichotoma) cultivados em WPM, inicialmente, o TDZ proporcionou uma grande proliferação de gemas, porém ao longo da cultura essas brotações se apresentaram malformadas, com caules curtos e retorcidos e folhas atípicas (Mantovani, Franco, Vestena,2001). Na propagação de Bauhinia cheilantha, utilizando-se o segmento nodal como fonte de explante, em meio WPM, maior número de gemas (4,3 e 2,1) foi obtido com 4,54 µM de TDZ e 6,66 µM de BAP, mas na presença do TDZ as brotações apresentaram-se menores (Gutiérrez et al., 2011).
Para formação de calos, a testemunha e os explantes cultivados na presença de 2,2 µM de cinetina não apresentaram diferença estatística, sendo nula ou baixa a porcentagem de calos nestes tratamentos. Porém, os tratamentos com diferentes concentrações de TDZ e 8,8 µM de cinetina apresentaram a maior porcentagem de calos na base dos explantes e diferiram estatisticamente da testemunha e dos tratamentos com 2,2 e 4,4 µM de cinetina. O enraizamento foi influenciado pela presença de TDZ e cinetina no meio de cultura, com diferença estatística entre a testemunha e os tratamentos com reguladores (Tabela 4).
Não houve diferença estatística entre os tratamentos que combinaram BAP e GA3 para o tamanho das brotações (cm), número de brotações/ segmento nodal e porcentagem de enraizamento. Para número de gemas e porcentagem de calos houve diferença estatística entre a testemunha e os tratamentos com adição de BAP e GA3 (Tabela 5). Segmentos nodais originaram a formação de múltiplas gemas na presença dos reguladores vegetais, independente da concentração de BAP utilizada. Nestes tratamentos, apesar de estatisticamente não haver diferença no número de brotações por segmento nodal e no tamanho, o tratamento com 2,2 µM BAP + 2 µM GA3 promoveu maior desenvolvimento dos eixos caulinares (2,92 cm de comprimento) o que tornou mais fácil a individualização, gerando, em média, 2,83 brotos/segmento nodal, aos 30 dias de cultura (Tabela 5). Para louro-pardo os melhores resultados para multiplicação e alongamento de segmentos nodais, com WPM contendo 0,44 µM de BAP combinado com 0,29 µM de GA3, resultou em 6,85 gemas/ explante (Mantovani, Franco, Vestena, 2001).
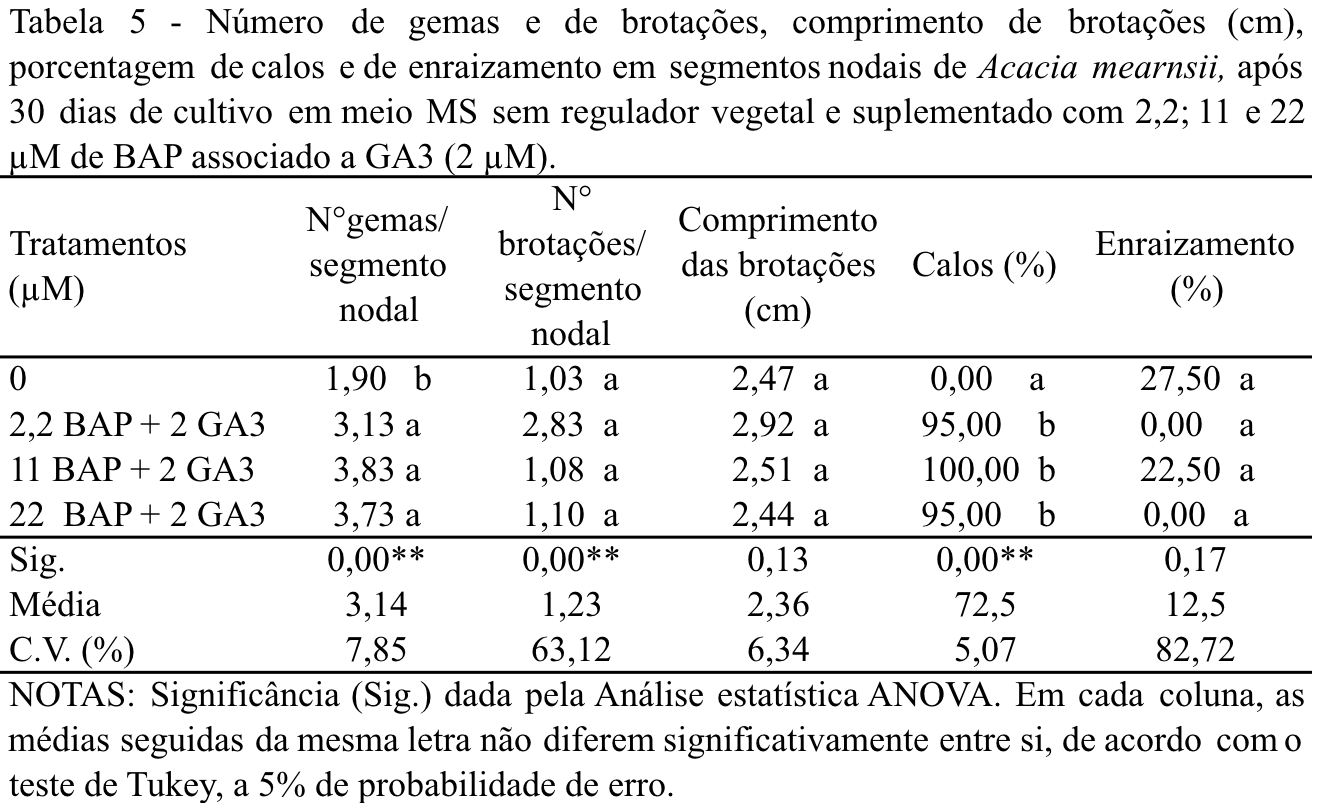
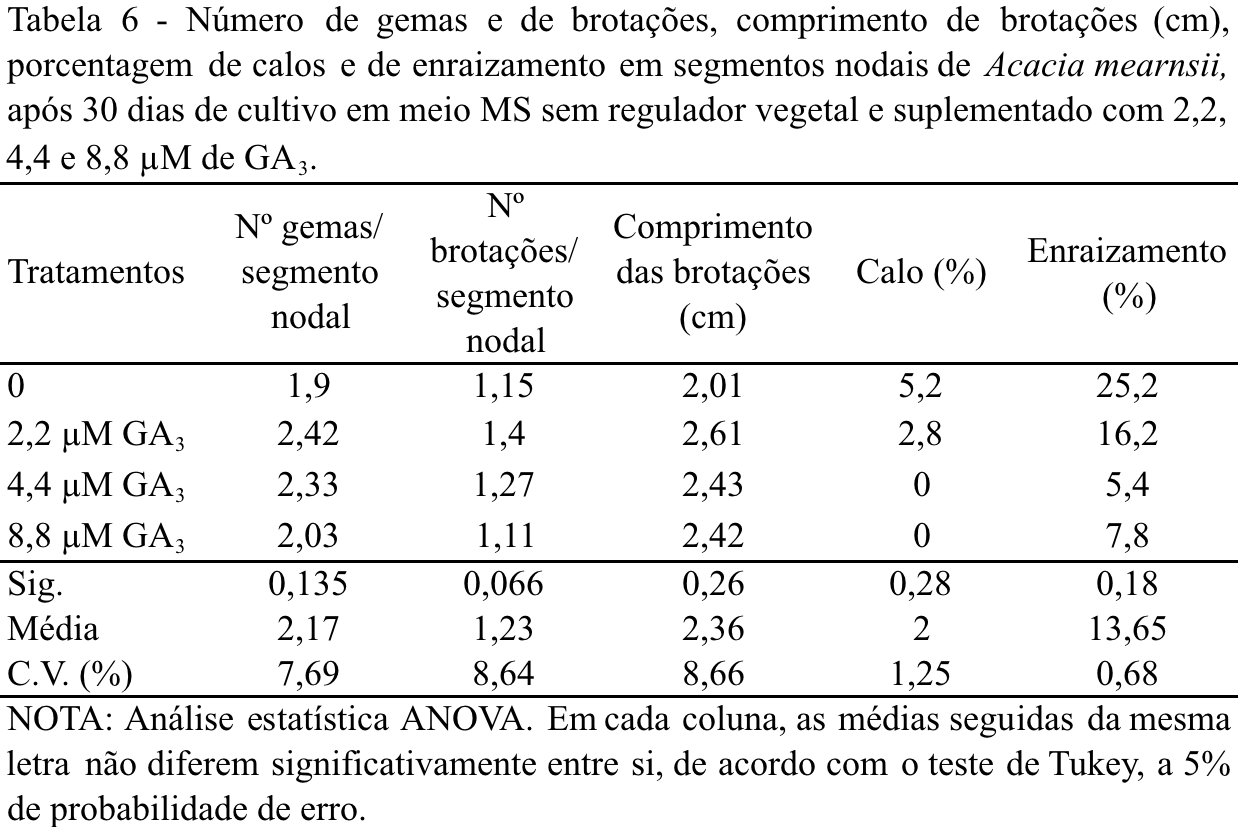
Não houve diferença significativa no alongamento de segmentos nodais em nenhuma das variáveis mensuradas para as concentrações de GA3 testadas (Tabela 6). Houve um ligeiro crescimento caulinar e aumento de número de gemas por segmento nodal nas culturas que receberam GA3, mas a taxa de enraizamento decresceu na presença do GA3. Em experimento testando o efeito de diferentes concentrações de GA3 em segmentos nodais de Piper hispidinervum, foi verificado que a adição de 2,89 µM de GA3 em WPM com metade dos sais, induziu alongamento caulinar, mas em concentrações mais elevadas houve inibição do crescimento de raízes adventícias (Simões et al., 2012). A presença de ácido giberélico no WPM reduziu a formação e multiplicação dos brotos em segmentos nodais de Ficus carica e induziu o estiolamento e, quando aplicado em concentrações elevadas (17,32 e 23,09 µM de GA3), reduziu o número de raízes e o peso da matéria fresca e seca do sistema radicial (Fráguas, Pasqual, Pereira, 2004). A adição de GA3 no meio de cultura pode ser eficaz no desenvolvimento e alongamento da parte aérea, porém pode diminuir ou impedir a formação de raízes adventícias (George et al., 2008, 501 p.).
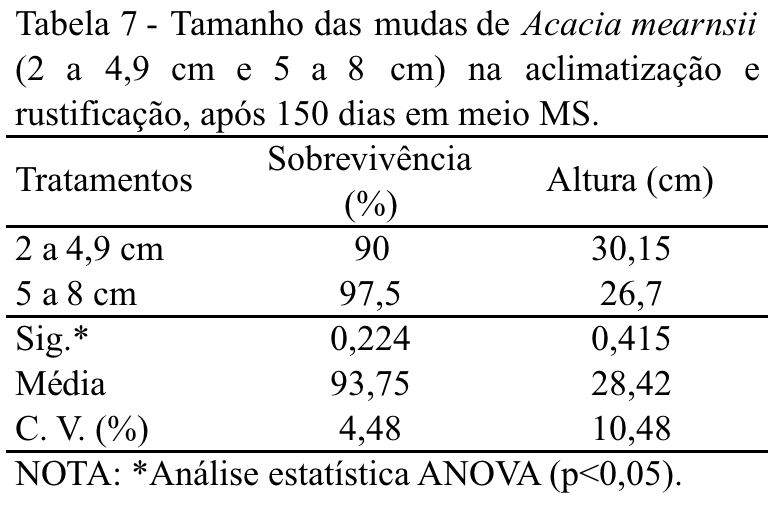
Na aclimatização ex vitro, a porcentagem de sobrevivência das mudas foi alta (90 e 97%) independente das classes de tamanhos. Não houve diferença estatística entre as variáveis taxa de sobrevivência e altura das mudas aos 150 dias de instalação no viveiro. As mudas apresentaram, em média, 28 cm de altura, após 150 dias (Tabela 7). A aclimatização da espécie apresentou-se positiva sendo realizada diretamente em casa de enraizamento com temperatura em torno de 27ºC e 92% de umidade, por 40 dias. A rustificação em casa de sombra com sombrite 50% por uma semana e depois a sol pleno também apresentou-se adequada.
De acordo com os resultados obtidos no presente trabalho conclui-se que:
A adição de BAP na concentração 8,8 µM no meio de cultura MS ¾ proporciona a maior taxa de multiplicação de gemas (5,89/segmento nodal);
O carvão ativado adicionado ao meio de cultura MS ¾ promove maiores taxas de multiplicação e melhora a taxa de enraizamento;
Para os tratamentos com adição de cinetina e TDZ, a melhor taxa de multiplicação é obtida com o uso de 0,4 µM de TDZ com 3,59 gemas/segmento nodal;
Entre as concentrações de BAP combinada com 2 µM GA3 a melhor taxa de multiplicação (3,83 gemas/ segmento nodal) é obtida com 11 µM de BAP e 2 µM GA3;
O efeito do GA3 no alongamento de segmentos nodais não é relevante e influencia negativamente a taxa de enraizamento;
A taxa de sobrevivência na aclimatização/rustificação de Acacia mearnsii é alta (em média 93%) e independe do tamanho inicial das mudas transferidas para o viveiro.
Á empresa TANAGRO® e à Capes, pelo auxílio financeiro, com a concessão de bolsa a primeira autora.
ABRAF - Associação Brasileira de Produtores de Florestas Plantadas (2013). Anuário estatístico da ABRAF 2013 ano base 2012. Recuperado de http://www.ipef.br/estatisticas/relatorios/anuario-abraf13-br.pdf
Borges Júnior, N., Soborsa, R. C., Martins-Coder, M. P. (july/ august, 2004). Multiplicação in vitro de gemas axilares de acácia-negra (Acacia mearnsii De Wild.). Revista Árvore, 28(4), 493- 498.
Correia, G., Graça, M. E. C. (1995). In vitro propagation of Black wattle (Acacia mearnsii De Wild). IPEF, Piracicaba, 48/49, 117 -125.
Couto, J. M. F., Otoni, W. C., Pinheiro, A. L., Fonseca, E. P. (2004). Desinfestação e germinação in vitro de sementes de mogno (Swietenia macrophylla King). Revista Árvore, 28(5), 633-642.
Dewan, A., Nanda, K, Shrish, C. G. (1992). In vitro micropropagatiosn of Acacia nilotica subsp. indica Brenan via cotyledonary nodes. Plant Cell Reports, 12, 18-21.
Disarz, R., Corder, M. P. M. (julho/agosto, 2009). Multiplicação de gemas axilares de Acacia mearnsii De Wild. sob diferentes meios de cultura. Revista Árvore, 33(4), 599-606.
Fráguas, C. B., Pasqual, M., Pereira, A. R. (janeiro/ fevereiro, 2004). Multiplicação in vitro de Ficus carica l.: efeito da cinetina e do ácido giberélico. Ciências e Agrotecnologia, 28(1), 49-55.
George, E. F., Hall, M. H., De Klerk, G. J. (2008). Plant Propagation by Tissue Culture, volume 1. 3 ed. Dordrecht: Springer.
Girijashankar, V. (february, 2011). Micropropagation of multipurpose medicinal tree Acacia auriculiformis. Journal of Medicinal Plants Research, 5(3), 462-466.
Gutiérrez, I. E. M. de, Nepomuceno, C. F., Ledo, C. A. da S., Santana, J. R. F. de. (fevereiro, 2011). Regeneração in vitro via organogênese direta de Bauhinia cheilantha. Ciência Rural, 41(2), 260-265.
Kaur, K., Kant, U. (2000). Clonal propagation of Acacia catechu Willd. by shoot tip culture. Plant Growth Regulation, 31, 143 - 145.
Kerbauy, G. B. (2004). Fisiologia vegetal. Rio de Janeiro: Guanabara Koogan.
Mantovani, N. C., Franco, E. T. H., Guerra, M. P., Hoppe, J. M. (1999). Micropropagação de caixeta, Didymopanax morototoni (Aubl.) Dcne. et Planch. Ciência Florestal, 9(1), 47-61.
Mantovani, N. C., Franco, E. T. H., Vestena, S. (2001). Regeneração in vitro de louro-pardo (Cordia trichotoma (Vellozo) Arrabida ex Steudel). Ciência Florestal, 11(2), 93-101.
Murashige, T., Skoog, F. A. (july, 1962). Revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 15(3), 473-497.
Oliveira, L. M., Paiva, R., Santana, J. R. F. de, Pereira, F. D., Nogueira, R. C., Silva, L. C. (november/ december, 2010). Effects of cytokinins on in vitro mineral accumulation and bud development in Annona glabra L.Ciências Agrotecnologia, 34(6), 1439-1445.
Paula, K. R. de (2005). Fatores ambientais e genéticos na produção de sementes de Acacia-negra. (Dissertação de mestrado). Programa de pós-graduação em Engenharia Florestal. Universidade Federal do Paraná. Curitiba.
Quoirin, M., Bittencourt, J. M., Zanette, F., Oliveira, D. E. (1998). Effect of growth regulators on indirect organogenesis of Acacia mearnsii tissues cultured in vitro. Revista Brasileira de Fisiologia Vegetal, 10(2), 101-105.
Quoirin, M., Silva, M. C., Martins, K. G., Oliveira, D. E. (2001). Multiplication of juvenile black wattle by microcuttings. Plant Cell, Tissue and Organ Culture, 66(3), 199-205.
Roversi, T., Mattei, V., Silveira J. R. P., Falck, G. (maio/agosto, 2002). Superação da dormência em sementes de acácia negra (Acacia mearnsii Willd.). Revista Brasileira de Agrociência, 8(2), 161-163.
Simões, M. A., Vasconcelos, J. M., Oliveira, J. P. de, Beltrão, R. T., Manfio, C. E., Fermino Júnior, P. C. P., Raposo, A. (janeiro/junho, 2012). Efeito do ácido giberélido (AG3) no alongamento in vitro de plântulas de pimenta longa (Piper hispidinervum C. DC.) durante a micropropagação. Amazônia: Ciências & Desenvolvimento, 7(14), 33-41.
Skirvin, R. M. (1981). Fruticulture crops. In: Conger, B. V. (eds.), Cloning agricultural plants via invitro techniques (p. 51-139). Boca Raton: CRC Press.
Taiz, L., Zeiger, E. (2009). Fisiologia vegetal. 4. ed. Porto Alegre: Artmed.
Ziv, M. (1991). Vitrification: morphological and physiological disorders of in vitro plants. In: Debergh, P. C., Zimmerman, R. H. (eds.), Micropropagation: technology and application (p. 49-69). Dordrecht: Kluwer Academic.
1. Mestre do Departamento de Ciências Florestais, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR
2. Professora do Departamento de Ciências Florestais, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR. giobomfim@ufpr.br
3. Professor do Departamento de Botânica, Setor de Ciências Biológicas, Universidade Federal do Paraná, Curitiba – PR
4. Pós-doutoranda do Departamento de Ciências Florestais, Escola Supeior de Agricultura Luiz de Queiroz, Piracicaba-SP
5. Professor do Departamento de Ciências Florestais, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR