 HOME | ÍNDICE POR TÍTULO | NORMAS PUBLICACIÓN
HOME | ÍNDICE POR TÍTULO | NORMAS PUBLICACIÓN Espacios. Vol. 37 (Nº 31) Año 2016. Pág. 18
Vânia Beatriz CIPRIANI 1; Juliana GARLET 2; Bruna Martins de LIMA 3; Vinicius Teixeira ARANTES 4
Recibido: 07/06/16 • Aprobado: 24/06/2016
RESUMO: O objetivo deste estudo é determinar as características biométricas e o melhor método de superação de dormência para sementes de Schefflera morototoni. Para caracterização da biometria foram medidas 200 sementes, e para superação de dormência foram usados 8 tratamentos: Testemunha (T1), imersão em ácido sulfúrico por 30 minutos (T2), imersão em soda caustica 40% por 10, 20 e 40 minutos (T3, T4, T5), imersão em soda caustica 70% por 20 e 40 minutos (T6, T7), e imersão em água quente até esfriar (T8). Os tratamentos aplicados não apresentaram diferenças estatísticas, entretanto recomenda-se o tratamento T3 pois apresentou maior percentual de germinação. |
ABSTRACT: The aim of this study is to determine the biometric features and the best method of scarification for Schefflera morototoni seeds. For characterization of biometrics were measured 200 seeds, and dormancy breaking were used eight treatments: control ( T1), immersion in sulfuric acid for 30 minutes ( T2), soda immersion caustic 40 % for 10, 20 and 40 minutes (T3 , T4, T5 ), caustic soda 70 % immersion for 20 and 40 minutes (T6 , T7 ), and immersion in hot water until cool (T8 ). The treatments did not differ, however the T3 treatment because it is recommended presented the highest percentage of germination. |
Shefflera morototoni é uma espécie de ocorrência em diversos biomas brasileiros entre eles a Amazônia, pertence à família Araliaceae é conhecida vulgarmente como mandiocão ou morototó, apresenta como sinonímia Didymopanax morototoni (Aubl.) Decne. & Planch. Sua madeira tem diversos usos entre eles aglomerados, brinquedos, carpintaria, compensado, construção (forro, lambril, esquadria), produção de celulose com rendimento de 52,5%, e suas sementes são utilizadas em artesanatos (MACIEIRA et al., 2014).
Além destas finalidades o mandiocão é uma espécie nativa brasileira com características pioneiras e com bom desenvolvimento em ambientes perturbados, sendo assim uma espécie potencial para utilização em recuperação de áreas degradadas (CARVALHO, 2002).
O desenvolvimento da consciência ambiental e a procura por diversas técnicas de recuperação requer conhecimento prático das espécies que serão utilizadas, a falta de conhecimento de fatores como a dormência e germinação de espécies florestais principalmente nativas, pode acarretar problemas econômicos em viveiros como a restrição da variabilidade genética, e baixa germinação, dificultando o processo de recuperação (ROCHA et al., 2014).
Carvalho (2002) afirma que a Shefflera morototoni apresenta dormência do tipo tegumentar pouco acentuada. A dormência caracteriza-se pela incapacidade de germinação das sementes mesmo quando se encontram em condições ambientais favoráveis (OLIVEIRA, 2012).
Entre as principais causas da dormência estão a impermeabilidade a água, interferências nas trocas gasosas, restrições mecânicas do tegumento, embrião imaturo e presença de substancias inibidoras (OLIVEIRA, 2012). Dentre os principais métodos de superação de dormência em sementes de espécies florestais estão as escarificações mecânicas e químicas, imersão em água quente, tratamentos com ácidos e bases fortes, pré-resfriamento entre outros (PEREIRA et al., 2015). Algumas técnicas foram descritas para superação de dormência em S. mototoni entre elas estão a imersão em água a temperatura ambiente por 12 horas, imersão em água quente, escarificação com ácido sulfúrico por cinco minutos entre outros (CARVALHO, 2002).
A biometria de frutos e sementes é importante para o conhecimento das espécies, são instrumentos para detectar a variabilidade genética existente dentro de uma população, na maioria dos casos estudos biométricos e de superação de dormência são de extrema importância para o manejo da espécie (ARAÚJO et al., 2014).
Assim, o objetivo do presente trabalho é determinar a biometria das sementes, o número de sementes por quilo e o método mais eficiente para superação de dormência de S. morototoni.
As sementes utilizadas nos testes foram provenientes do Instituto Ouro Verde localizado em Alta Floresta –MT. Estas foram coletadas por produtores cadastrados no instituto, sendo as mesmas oriundas de coleta no ano de 2014, nos municípios: Apiacás, Alta Floresta, Carlinda, Colíder, Nova Guarita, Nova Canãa do Norte, Terra Nova do Norte e Nova Santa Helena, norte do estado de Mato Grosso. O lote de sementes avaliado encontrava-se armazenado em saco de papel á temperatura de aproximadamente 23 ºC.
Os testes de superação de dormência bem como a caracterização biométrica das sementes foram realizados nos laboratórios de Sementes e Citologia Vegetal, da Universidade do Mato Grosso, no campus II da instituição localizada em Alta Floresta MT. O teste de umidade foi realizado segundo especificação da RAS (BRASIL, 2009), em estufa á 105ºC por 24 horas.
Para a caracterização biométrica 200 sementes foram selecionadas do lote e procedeu-se a medição do comprimento e largura com a utilização de paquímetro digital. Para os dados de peso de 1000 sementes e quantidade de sementes por quilo foram pesadas cinco amostras contendo 100 sementes cada, em balança de precisão (0,001 g).
Para a superação de dormência foram utilizadas oitocentas sementes, divididas em quatro repetições de 25 sementes para cada um dos 8 tratamentos, sendo os tratamentos constituídos de: Testemunha sem superação (T1), imersão em ácido sulfúrico por 30 minutos (T2), imersão em soda caustica 40% por 10, 20 e 40 minutos (T3, T4, T5), imersão em soda caustica 70% por 20 e 40 minutos (T6, T7), imersão em água quente até esfriar (T8).
Inicialmente as sementes foram desinfestadas em hipoclorito de sódio concentração de 1% segundo recomendação do MAPA (BRASIL, 2013), posteriormente submetidas aos tratamentos, dispostas em substrato de rolo de papel (umedecidos 2,5 vezes o seu peso) e acomodadas em B.O.D. com temperatura de 25ºC e fotoperíodo de 12 horas.
A contagem do número de sementes germinadas foi realizada diariamente iniciando aos 36 dias até a estabilização do número de sementes germinadas aos 59 dias. Foram consideradas germinadas as sementes que originaram plântulas normais (conforme Regra Brasileira para Análise de Sementes). Assim, avaliou-se a porcentagem de plântulas na primeira contagem (aos 36 dias), germinação final do teste (aos 59 dias), e Índice de Velocidade de Germinação (IVG), calculado pela fórmula apresentada por Maguire (1962) ![]() onde G= número de sementes germinadas, e N= dias da instalação do teste.
onde G= número de sementes germinadas, e N= dias da instalação do teste.
Os dados foram submetidos à análise de variância e as médias comparadas pelo teste Tukey a 5% de probabilidade. Utilizou-se o programa estatístico Assistat 7.6 Beta (SILVA; AZEVEDO, 2009), para realização de todas as análises estatísticas efetuadas neste estudo.
O lote de sementes avaliado neste estudo apresentou teor de umidade de 7,06%. O peso de 1.000 sementes de Schefflera morototoni é de 19,5 g e o número de sementes por quilo corresponde a aproximadamente 51.283 sementes. Carvalho (2002) afirma que o número de sementes pode variar de 35.000 a 99.000.
As sementes apresentam em média 4,93 mm de comprimento e 4,21 mm de largura (Tabela 1).
Tabela 1. Comprimento e largura das sementes de Schefflera morototoni.
Dimensão (mm) |
Mínimo |
Média |
Máximo |
Desvio Padrão |
Comprimento |
3,83 |
4,94 |
6,06 |
0,43 |
Largura |
3,38 |
4,21 |
5,27 |
0,39 |
Considerando os tratamentos aplicados não houve diferença estatística tanto em relação a Primeira Contagem como na Germinação Final (Tabela 2), entretanto os tratamentos utilizando soda caustica 40% por 10 minutos e ácido sulfúrico por 30 minutos apresentaram maiores valores de Germinação Final.
Tabela 2. Médias da Primeira Contagem e Germinação Final para sementes de Schefflera morototoni.
Tratamentos |
PC % |
GF % |
Testemunha |
8a |
46a |
AS 30 M |
10a |
52a |
SC 40% - 10 M |
6a |
60a |
SC 40% - 20 M |
10a |
54a |
SC 40% - 40 M |
14a |
55a |
SC 70% - 20 M |
9a |
51a |
SC 70% - 40 M |
5a |
36a |
AQ Imersão |
2a |
44a |
CV % |
81,97 |
31,20 |
AS = ácido sulfúrico por 30 minutos, SC 40% - 10 M = soda caustica a 40% de concentração por 10 minutos, SC 40% - 20 M = soda caustica a 40% de concentração por 20 minutos, SC 40% - 40 M = soda caustica a 40% de concentração por 40 minutos, SC 70% - 20 M = soda caustica a 70% de concentração por 20 minutos, SC 70% - 40 M = soda caustica a 70% de concentração por 40 minutos, AQ Imersão = água quente em imersão. Médias seguidas pela mesma letra na coluna não diferem estatisticamente pelo Teste de Tukey (p>0.05).
As sementes tratadas com soda caustica apresentaram germinação de 60%. Freitas et al. (2011) avaliando a utilização de soda caustica para remoção de sarcotesta, camada inibitória da germinação em sementes de Jaracatia spinosa (Caricaceae), obteve 48% de germinação das sementes, entretanto este valor foi inferior a escarificação com areia. Já para sementes de Murdannia nudiflora (Commeliaceae) técnicas envolvendo a imersão em soda caustica por cinco minutos mostraram-se ineficientes para superação de dormência com apenas 2,5% de germinação (ERASMO et al., 2008).
O uso da soda caustica é uma forma alternativa de superação de dormência tegumentar, pois o ácido sulfúrico forma mais indicada nem sempre é de fácil aquisição. A soda caustica apresenta o mesmo modo de ação que o ácido sulfúrico promovendo o rompimento do tegumento e permitindo a penetração de água no interior das sementes (SILVA et al., 2015).
Entretanto Silva et al. (2015) afirmam ainda que assim como o ácido sulfúrico é preciso cautela ao utilizar este produto pois um período elevado de exposição pode danificar o embrião das sementes e inviabilizar a germinação. Em seu estudo analisando diferentes métodos de superação de dormência de Euterpe oleraceae o uso da soda caustica danificou as sementes ao ponto de não haver nenhuma germinação neste tratamento.
Franco e Ferreira (2002) avaliando a superação de dormência em sementes de Didymopanax morototoni sinonímia da Schefflera morototoni observou que os tratamentos utilizando ácido sulfúrico 70% por 5 e 10 minutos não foram eficientes para que houvesse germinação desta espécie. Entretanto assim como no presente estudo e para outras espécies florestais o ácido proporciona bons índices de germinação.Como exemplo pode-se citar Samanea tubulosa (Fabaceae) que apresentou germinação acima de 70% quando imersa em ácido sulfúrico concentrado por 15 minutos (OLIVEIRA et al., 2012). Pereira et al. (2015) avaliando a dormência de sementes de Tachigali myrmecophila verificaram a eficiência da imersão em ácido sulfúrico por 20 minutos que proporcionou germinação de 81%.
Assim como na Primeira Contagem e na Germinação Final não foi observada diferença estatística no Índice de Velocidade de Germinação (Figura 1). Apesar de não haver diferenças estatísticas entre os tratamentos a imersão em soda caustica 40% por 10 minutos apresentou melhor valor de IVG, 5,24. Freitas et al. (2011) observou IVG de 7,88 em sementes de Jaracatia spinosa expostas a soda caustica por 30 minutos.
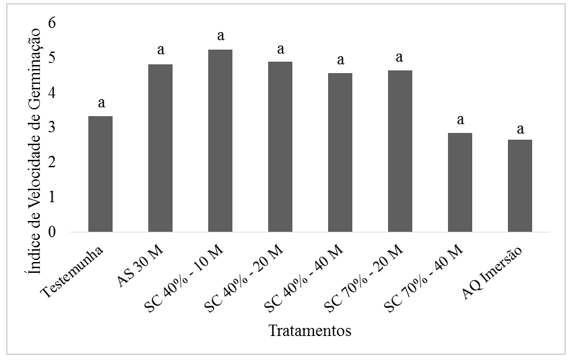
Figura 1. Médias do Índice de Velocidade de Germinação para os diferentes
tratamentos de superação de dormência em Schefflera morototoni.
AS = ácido sulfúrico por 30 minutos, SC 40% - 10 M = soda caustica a 40% de concentração por 10 minutos, SC 40% - 20 M = soda caustica a 40% de concentração por 20 minutos, SC 40% - 40 M = soda caustica a 40% de concentração por 40 minutos, SC 70% - 20 M = soda caustica a 70% de concentração por 20 minutos, SC 70% - 40 M = soda caustica a 70% de concentração por 40 minutos, AQ Imersão = água quente em imersão. Médias seguidas pela mesma letra na coluna não diferem estatisticamente pelo Teste de Tukey (p>0.05).
Pereira et al. (2015) observaram Índice de Velocidade de Germinação de 4 para tratamentos com utilização de ácido sulfúrico por 20 minutos em sementes de Tachigali myrmecophila. Oliveira et al. (2012) afirmam ainda em seu estudo que o uso do tratamento de ácido sulfúrico proporcionou maior Índice de Velocidade de Germinação (aproximadamente 5,5) em sementes de Samanea tubulosa.
O tratamento com imersão em água quente até esfriar apresentou dentre os demais tratamentos o menor valor de IVG (2,65), resultados diferentes daqueles encontrados por Lima et al. (2013) que observou IVG de 17,10 para sementes de Delonix regia (Fabaceae) submetidas a água quente por cinco minutos.
As sementes de S. morototoni apresentam em média 4,93 mm de comprimento e 4,21 mm de largura, peso de 1.000 sementes de 19,5 g e aproximadamente 51.283 sementes por quilo.
Não houve diferença entre os tratamentos utilizados para superação de dormência de S. morototoni, entretanto o tratamento com imersão em soda caustica 40% por 10 minutos proporcionou melhor porcentagem de Germinação Final e melhor IVG.
ARAÚJO, A. M. S.; TORRES, S. B.; NOGUEIRA, N. W.; FREITAS, R. M. O.; CARVALHO, S. M. C. Caracterização morfométrica e germinação de sementes de Macroptilium martii Benth. (Fabaceae). Revista Caatinga, Mossoró, v. 27, n. 3, p. 124-131, 2014.
BRASIL, Ministério da Agricultura, Pecuária e Abastecimento. Instruções para análise de sementes de espécies florestais, de 17 de janeiro de 2013, Brasília: MAPA, 2013. 98 p.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Regras para Análise de Sementes. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Brasília, DF: MAPA/ACS, 2009. 399p.
CARVALHO, P. E. R. Mandioção. Circular técnica 65, Colombo – PR: Embrapa, 2002.
ERASMO, E. A. L.; TERRA, M. A.; DOMINGOS, V. D.; MARTINS C. C.; COSTA, N. V. Superação de dormência em sementes de Murdannia nudiflora (L.) Brenan. Acta Scientiarum Agronomy, Maringá, v. 30, n. 2, p. 273-277, 2008.
FRANCO, E. T. H.; FERREIRA, A. G. Tratamentos pré-germinativos em sementes de Didymopanax morototoni (Aulb.) Dcne. et Planch. Ciência Florestal, Santa Maria, v. 2, n. 1, p. 1-10, 2002.
FREITAS, S. J.; BARROSO, D. G.; SILVA, R. F.; MARTINS, V. H. C. R.; FREITAS, M. D. S.; FERREIRA, P. R. Métodos de remoção de sarcotesta na germinação de sementes de jaracatiá. Revista Árvore, Viçosa – MG, v. 35, n. 1, p. 91-96, 2011.
LIMA, J. S.; CHAVES, A. P.; MEDEIROS, M. A.; RODRIGUES, G. S. O.; BENEDITO, C. P. Métodos de superação de dormência em sementes de flamboyant (Delonix regia). Revista Verde de Agroecologia e Desenvolvimento Sustentável, Mossoró – RN, v. 8, n. 1, p. 104-109, 2013.
MACIEIRA, A. P.; COSTA, C. C.; CARVALHO, L. T.; FIASCHI, P.; GOMES, J. I.; MARTINS-DA-SILVA, R. C. V.; MARGALHO, L. F. Conhecendo espécies de plantas da Amazônia: Morototó (Schefflera morototoni (Aulb.) Maguire, Steyerm. & Frodin – Araliaceae. 1ª. ed. Comunicado técnico nº 245, Belém – PA: Embrapa, 2014. 4p.
OLIVEIRA, L. M.; BRUNO, R. L. A.; ALVES, E. U.; SOUSA, D. M. M.; ANDRADE, A. P. Tratamentos pré-germinativos em sementes de Samanea tubulosa Bentham – (Leguminoseae – Mimosoideae). Revista Árvore, Viçosa, v. 36, n. 3, p. 433 – 440, 2012.
OLIVEIRA, O. S. Tecnologia de sementes florestais: espécies nativas. Curitiba: Ed. Da UFPR. 2012. 404p.
PEREIRA, D. S.; ARAÚJO, D. G.; SIMÕES, P. H. O.; PALHETA, L. F.; CORREIA, R. G. Superação de dormência em sementes de Tachigali myrmecophila (Ducke) Ducke. ENCICLOPÉDIA BIOSFERA, v. 11, n. 22, p. 2576 – 2588, 2015.
ROCHA, C. R. M.; COSTA, D. S.; NOVEMBRE, A. D. L. C.; CRUZ, E. D. Morfobiometria e germinação de sementes de Parkia multijuga Benth. Revista nativa, Sinop, v. 2, n. 1, p. 42-47, 2014.
SILVA, F. A. S. E. DA; AZEVEDO, C. A. V. DE. Principal Components Analysis in the Software Assistat-Statistical Attendance. In: WORLD CONGRESS ON COMPUTERS IN AGRICULTURE, 7, Reno-NV-USA: American Society of Agricultural and Biological Engineers, 2009.
SILVA, L. L. DA; LIMA-PRIMO, H. E. DE; SMIDERLE, O. J.; CHAGAS, E. A.; SOUZA, A. G. Escarificação de sementes para desenvolvimento em plântulas de açaizeiro. Revisa Agro@mbiente, Boa Vista – PR, v. 9, n. 1, p. 72-78, 2015.
MAGUIRRE, J, D, Speed of germination aid in selection and evaluation for seedling and vigor. Crop Science, Madison, v, 2, n, 2, p, 176-177, 1962.
1. Graduanda em Engenharia Florestal, Universidade do Estado de Mato Grosso, Alta Floresta – MT, e-mail: cipriani.bia@hotmail.com
2. Professora Doutora da Universidade Estadual de Mato Grosso, Alta Floresta – MT, e-mail: julianagarlet@unemat.br
3. Graduanda em Engenharia Florestal, Universidade do Estado de Mato Grosso, Alta Floresta – MT, e-mail: brunamartins_af@hotmail.com
4. Instituto Ouro Verde, Alta Floresta – MT, e-mail: vinaoarantes@hotmail.com