 HOME | ÍNDICE POR TÍTULO | NORMAS PUBLICACIÓN
HOME | ÍNDICE POR TÍTULO | NORMAS PUBLICACIÓN Espacios. Vol. 37 (Nº 23) Año 2016. Pág. 28
Simone AQUINO 1; Marcos Roberto PISCOPO 2
Recibido: 12/0416 • Aprobado: 12/05/2016
RESUMO: As diretrizes públicas brasileiras definem que o acesso aos medicamentos deve ser realizado de forma universal, de qualidade e ao menor custo. O objetivo do estudo exploratório e de natureza qualitativa foi analisar o gerenciamento na distribuição de medicamentos de alto custo aos usuários do Sistema Único de Saúde. A análise de conteúdo de 127 documentos como ações judiciais pelo Ministério Público, comunicações do Ministério da Saúde e resoluções da Agência Nacional de Vigilância Sanitária, no período de 2012 a 2014, demonstrou falhas de gestão entre as três esferas administrativas governamentais, motivando a judicialização, devido a falta de medicamentos antineoplásicos. |
ABSTRACT: Brazilian government guidelines establish that access to medicines should be done universally, quality and lower cost. The objective of the exploratory and qualitative study was to analyze the management in the distribution of high-cost medicines to users of the Unified Health System. The 127 documents content analysis as lawsuits by the Public Ministry, the Ministry of Health communications and resolutions of National Health Surveillance Agency, in the period 2012 to 2014, demonstrated management failures between the three governmental administrative spheres, motivating the legalization due to lack of antineoplastic drugs. |
É indiscutível a importância do gerenciamento da assistência nos serviços de saúde, ao lado de uma série de outros, que são de extrema relevância para a qualidade de vida da população. Esta ideia está contida no artigo 2º da Lei nº 8080 (BRASIL, 1990), onde a saúde é citada como "um direito fundamental do ser humano, devendo o Estado prover as condições indispensáveis ao seu pleno exercício". Em seu artigo 6º está definido o campo de atuação do Sistema Único de Saúde (SUS), incluindo as ações de assistência terapêutica integral, inclusive a farmacêutica.
De acordo com a Portaria nº 3.916 de 1998, o sistema de saúde brasileiro engloba estabelecimentos públicos e o setor privado de prestação de serviços, incluindo desde unidades de atenção básica até centros hospitalares de alta complexidade. Neste contexto, o SUS também adota como princípios, a universalidade em todos os níveis de assistência, integralidade e igualdade de assistência, dentre outras. Apesar do caráter universal dos princípios do SUS e a despeito do volume de serviços prestados, ainda persistem parcelas da população brasileira excluídas de algum tipo de atenção à saúde, contradizendo tais diretrizes. Essas mesmas diretrizes públicas, entretanto, definem que o acesso da população aos medicamentos deve ser realizado de forma segura, eficaz e com qualidade, porém, ao menor custo possível e que, os gestores do SUS, nas três esferas de governo (federal, estadual e municipal) atuem em estreita parceria, concentrando esforços no sentido de que o conjunto das ações, direcionadas para o alcance deste propósito, esteja alinhado (BRASIL, 1998).
Um aspecto fundamental da assistência farmacêutica é a acessibilidade econômica e que seu custo não suponha uma proporção excessiva da renda de forma que impeça sua compra ou obrigue o usuário a renunciar a outros bens básicos para poder adquirir os medicamentos dos quais precisa. Por outro lado, sob ponto de vista da administração pública, caso os medicamentos estejam cobertos por um seguro social e a dispensação seja gratuita ou subvencionada para o usuário, o custo continua sendo importante, pois pode impactar na sustentabilidade financeira do sistema. Os problemas de acesso se tornam mais graves no caso dos medicamentos de alto custo (OPAS, 2009).
Além disso, as demandas pelos serviços de saúde são sempre crescentes. O próprio êxito na redução da taxa de mortalidade infantil e no aumento da expectativa de vida, por exemplo, conduz a um maior contingente de indivíduos que necessitarão de cuidados, muitas vezes em decorrência de doenças degenerativas crônicas que passam a exigir, não raramente, a utilização de medicamentos excepcionais (DANTAS; SILVA, 2006).
Medicamentos de alto custo, também chamados de medicamentos órfãos ou excepcionais, e doenças raras são temas desafiantes para um gestor de saúde pública ou do setor privado, uma vez que vários aspectos estão envolvidos neste tipo de terapêutica especial. Na maioria dos casos, trata-se de medicamentos para doenças de grande impacto social e/ou com grave risco de morte (HIV/AIDS, doenças oncológicas etc.), ou uma população muito pequena (portadores de doenças raras). Ao se deparar com esta questão, surgem muitas dúvidas e dificuldades, ou seja, ao gerenciar os custos e aquisição de medicamentos considerados caros. Fatalmente o gestor irá se deparar com a falta de políticas públicas claras e direcionadas, além da dificuldade na aquisição financeira para uma terapia especial. Seja um tratamento de curto ou longo prazo, focando um grupo restrito de pacientes portadores de doenças raras (ou órfãs), muitas vezes a terapia só ocorre através de medidas judiciais (DANTAS; SILVA, 2006).
Sem uma definição uniforme, suas características encontram-se determinadas por diversos fatores: Sua aquisição constitui uma grande carga para o financiamento do sistema público de saúde e/ou gasto do bolso de famílias e indivíduos (OPAS, 2009). O Sistema Único de Saúde (SUS) não possui política de assistência farmacêutica específica para doenças raras, e a própria construção dessa política esbarra em questões bióeticas que envolvem temas como equidade, recursos escassos e reserva do possível (BRASIL, 1990; HÄBERLE, 1997). Além do mais, as decisões em saúde pública são tomadas por vários atores presentes em diversas esferas de interesse – gestores, indústria, financiadores, médicos, ministério público – progressivamente tem se fundamentado em evidências. Para isso, é necessário filtrar eficientemente a informação relevante para uma prática em particular ou uma determinada política, por meio de análise e síntese dos múltiplos esforços de pesquisa (COSTELLOE et al., 2010).
O objetivo do estudo proposto é o de analisar os principais conflitos entre os diferentes atoresenvolvidos com a questão sobre medicamentos de alto custo e as razões que geram as ações judiciais, pelo direito da aquisição de medicamentos excepcionais fornecido pelo SUS.
A questão de pesquisa, portanto, busca elucidar o seguinte dilema: Quais as objeções para o gestor público que o leva a não disponibilização e consequente judicialização para a aquisição de medicamentos excepcionais, contemplados na lista oficial do SUS?
Medicamento órfão é um termo usado para descrever medicamentos potencialmente úteis, não disponíveis no mercado; sua exploração não era considerada lucrativa por motivos como dificuldade de produção ou, ainda, por serem destinados ao tratamento de doenças raras (SILVA, 2000). Para a atribuição do status de medicamento órfão, dois conceitos são utilizados conjuntamente: o epidemiológico (prevalência ou incidência da doença numa população) e o econômico (presunção de não rentabilidade do medicamento destinado à terapêutica da doença em questão).
A Agência Nacional de Vigilância Sanitária (ANVISA) define medicamentos órfãos como aqueles "utilizados em doenças raras, cuja dispensação atende a casos específicos" (ANVISA, 2013). De acordo com Souza (2010) este conceito é pouco claro, sintético e incompleto, além disso, não há uma política específica para este grupo de fármacos. Nem todas as patologias podem ser consideradas raras e, o conceito de medicamento excepcional evoluiu no que se refere a "doenças raras", predominando a essência de que são aqueles destinados ao tratamento de moléstias crônicas, de caráter individual e cujo custo é elevado, seja pela própria cronicidade, seja pelo elevado valor unitário da substância medicamentosa(DANTAS; SILVA, 2006). Portanto, não existe consenso sobre a definição de medicamentos de alto custo. Porém o conceito apresentado pelo Ministério da Saúde (2010) o Medicamentos de alto custo são aqueles cujo valor unitário mensal esteja acima de um salário mínimo, ou medicamentos de uso crônico indicado para doenças muito prevalentes (acima de 1% da população) cujo custo mensal seja superior a um terço de um salário mínimo.
A própria qualificação de "excepcional", em verdade, revela que o medicamento é aquele que constitui exceção, envolvendo doenças que, embora nem sempre raras, atingem um número reduzido da população. Logo, são mais caros, porque são produzidos em menor escala, mas não deixam de ser essenciais, na medida em que, dentro de sua excepcionalidade, asseguram a vida e o bem estar do usuário (DANTAS; SILVA, 2006).
O Ministério da Saúde instituiu por meio da Portaria nº 2.577, de 27 de outubro de 2006, criou o denominado Componente de Medicamentos de Dispensação Excepcional (CMDE), como parte integrante da Política Nacional de Assistência Farmacêutica. Na realidade o modelo do CMDE surgiu, em 1993, com a denominação de "Programa de Medicamentos Excepcionais", e seu objetivo inicial era o de disponibilizar gratuitamente à população medicamentos de uso ambulatorial, de alto custo, e que não pudessem ser comprados pelos cidadãos.
Este programa era cofinanciado pelos governos estadual e federal, e possui uma lista de medicamentos específica, definida na própria portaria de sua criação (SES, 2013). A disponibilização destes medicamentos atendia aos seguintes critérios (DANTAS; SILVA, 2006):
a) doença rara ou de baixa prevalência, com indicação de uso de medicamento de alto valor unitário ou que, em caso de uso crônico ou prolongado, seja um tratamento de custo elevado;
b) doença prevalente, com uso de medicamento de alto custo unitário ou que, em caso de uso crônico ou prolongado, seja um tratamento de custo elevado, desde que: b.1) haja tratamento previsto para o agravo no nível de atenção básica, ao qual o paciente apresentou necessariamente intolerância, refratariedade ou evolução para quadro clínico de maior gravidade, ou b.2) o diagnóstico ou estabelecimento de conduta terapêutica para o agravo estejam inseridos na atenção especializada.
Atualmente a lista conta com 133 medicamentos de acordo com os dados da Secretaria Estadual da Saúde (SES, 2013), mas segundo Souza et al. (2010), alguns problemas são evidenciados no CMDE: (1) Embora o programa exista desde 1993 as modificações subsequentes (inclusão e exclusão de medicamentos), carece ainda de diretrizes claras que estabeleçam seu conceito e os critérios de inclusão/exclusão de medicamentos na lista; (2) O programa custou, em 2005, aproximadamente R$ 1,2 bilhão (cerca de 1/3 dos investimentos para todos os programas de medicamentos).
Segundo Carias et al. (2011) medicamentos de dispensação excepcional ou de alto custo despendeu em 2003, recursos da ordem de R$ 516 milhões e, em 2006, foi responsável pelo gasto de R$ 1,3 bilhão a preços de 2003, perfazendo aumento real de 159% no período, o que o torna, atualmente, um dos grandes componentes no aumento dos gastos com medicamentos do Ministério da Saúde. A maior parte desse orçamento destina-se ao tratamento de um pequeno número de pacientes. Quatorze medicamentos da lista são responsáveis por 60% de seu custo. A Figura 1 demonstra o aumento dos gastos anuais per capita em reais do Ministério da Saúde (MS) com medicamentos do Programa de Medicamentos de Dispensação em Caráter Excepcional (MDCE).
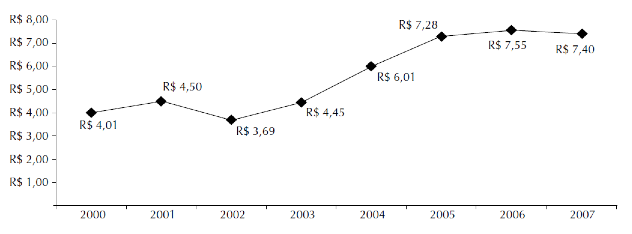
Figura 1. Aumento dos gastos anuais per capita em reais do MS com medicamentos do Programa MDCE.
Fonte: CARIAS et al. (2011).
O vultoso montante de recursos públicos envolvidos tem impulsionado os gestores de saúde ao contínuo estudo da legislação pertinente, com elaboração de diversos trabalhos e pesquisas. As objeções dos gestores de saúde são ou de caráter socioeconômico ou de caráter técnico para a negativa do poder público, de acordo com Dantas e Silva (2006). O Quadro 1 demonstra as principais objeções para o fornecimento de medicamentos de alto custo.
Quadro 1. Objeções dos gestores para o não fornecimento de medicamentos de alto custo.
Objeções de caráter socioeconômico |
Objeções de caráter técnico |
O alto custo do medicamento excepcional e escassez de recursos financeiros invoca a denominada reserva do possível. |
A não aquisição do medicamento pelos trâmites licitatórios como fator preponderante do consequente não fornecimento, embora constante em lista oficial. |
A doutrina da reserva do possível condiciona o reconhecimento dos direitos subjetivos a prestações à disponibilidade dos recursos públicos (faz-se o possível dentro dos limites orçamentários). |
A aquisição dos insumos depende de vários órgãos governamentais, diversos setores, inúmeros atos burocráticos e com prazos definidos. |
Os possíveis interesses econômicos da indústria farmacêutica. Os medicamentos excepcionais, por sua própria natureza, importância e especificidade, estão umbilicalmente ligados ao surgimento de novas tecnologias e com isso, atrelados ao elevado investimento financeiro. |
Falta de dinâmica de planejamento: seleção, programação, aquisição, armazenamento, distribuição, controle de qualidade e a utilização (nessa compreendida a prescrição e a dispensação) de medicamentos excepcionais, bem como sobre cadastramento de usuários e programação. |
Ao contrário de outros setores, no ramo dos fármacos a inovação é acompanhada pelo incremento nos custos, sobretudo devido às patentes e à necessidade de remunerar as investidas privadas nos esforços de pesquisa a bem da saúde da população. |
A não previsão em listas oficiais de medicamentos por falta de mecanismos de revisão periódica ou permanente das listas, bem como, mecanismos de inclusão e exclusão de medicamentos em face do avanço da ciência e da alteração do perfil epidemiológico da população. |
O laboratório produtor, após o investimento em Pesquisa e Desenvolvimento (P & D) obtém a patente, ganhando exclusividade na sua comercialização. |
A inclusão demorada e burocrática de medicamento excepcional em lista oficial. |
A ausência de registro do medicamento excepcional na ANVISA. |
Fonte: DANTAS & SILVA (2006).
Em novembro de 2009, a Portaria GM/MS n° 2.981 constituiu outro marco importante, pois alterou a definição e denominação do programa, que passou a ser tratado como Componente Especializado da Assistência Farmacêutica (CEAF).
A referida portaria definiu o programa como estratégia de acesso a medicamentos no âmbito do Sistema Único de Saúde, caracterizado pela busca da integralidade do tratamento medicamentoso na assistência ambulatorial, cujas linhas de cuidado foram definidas em protocolos clínicos e diretrizes terapêuticas (PCDT), publicados pelo Ministério da Saúde. Com a nova portaria, as formas de acesso aos medicamentos e seu financiamento foram modificados, garantindo que a distribuição ocorresse mediante a pactuação entre a União, Estados, Distrito Federal e municípios, com responsabilidades distintas (CARIAS et al., 2011). Porém, os conflitos gerados entre médicos, pacientes e gestores públicos em qualquer uma das esferas (federal, estadual e municipal) ainda são evidentes, como exemplo da demanda de ações judiciais movidas pelos próprios pacientes.
De acordo com Gandini, Barione e Souza (2007) o dilema da implementação do direito à saúde no Brasil por meio do cumprimento de decisões judiciais tem suscitado discussões das mais diversas, dentre as quais se destaca o confronto direto de dois princípios: de um lado aquele que afirma ser dever do Estado garantir aos indivíduos um núcleo mínimo de direitos, sem os quais não há falar-se em vida digna; de outro, o princípio que estabelece que a atuação do Estado é limitada diante da indisponibilidade de recursos financeiros para atender e efetivar todos os direitos fundamentais sociais. Este é, pois, o famoso embate entre o mínimo existencial e a reserva do possível ou "reserva de consistência", segundo Häberle (1997).
Em contraposição a essa intenção do Poder Judiciário de tornar efetivo o direito à saúde, surge o problema da limitação orçamentária do Estado, que é o principal argumento lastreador do princípio da reserva do possível. A ideia é simples: só se pode exigir do Estado a execução de uma prestação ou o atendimento de um interesse em benefício de alguém, desde que essa medida não onere os cofres públicos ao ponto de inviabilizar o atendimento de outras pessoas ou comprometer a implementação de políticas públicas em outras áreas sociais. Há, porém, aqueles que divergem frontalmente do princípio da reserva do possível, pois afirmam tratar-se de teoria criada pelo Direito alemão e que em nada atende à realidade brasileira (GANDINI; BARIONE; SOUZA, 2007).
Bastos e Seidel (1992) apontaram que os hospitais e seus stakeholders (médicos, gestores e pacientes) torna a gestão da assistência farmacêutica como uma relação mista entre dois conceitos de organizações, as especializadas e não-especializadas, onde a posição do administrador defende a manutenção financeira do sistema em contraposição ao do médico especialista, que irá beneficiar o cliente (paciente) na busca do melhor atendimento terapêutico, sem levar em conta o custo do medicamento/tratamento.
Para Blau e Scoot (1969) o conflito é fonte de mudança organizacional, pois leva à criação de novas práticas e técnicas de como lidar com a situação conflitante. Por sua vez, as inovações conduzem a novos conflitos, em processo dialético contínuo. Os autores ainda apontam que além dos conflitos entre autoridade e especialistas (denominado disciplina burocrática versus competência profissional), existem dois outros conflitos ou dilemas organizacionais (coordenação versus comunicação e planejamento administrativo versus iniciativa). O Quadro 2 aponta as principais diferenças entre as posições de administradores e especialistas.
Quadro 2. Diferenças dos interesses de administradores e especialistas que deflagram conflitos nas organizações.
Administradores |
Especialistas |
Representam os interesses da organização |
Representam os interesses dos clientes (pacientes) |
Fonte de autoridade repousa no contrato legal |
Fonte de autoridade repousa no conhecimento técnico |
Decisões controladas pela busca de disciplina/ obediência aos superiores |
Governados por padrões profissionais internacionais internalizados |
O gerente é a instância que julga a decisão de um burocrata |
No grupo de especialistas a decisão ocorre entre os colegas do grupo. |
Fonte: Adaptado de Blau e Scoot (1969).
Este estudo é considerado exploratório a fim de compreender os fatores que interferem na disponibilidade de medicamentos autorizados pela ANVISA e incluídas na lista de medicamentos de alto custo do Ministério da Saúde (MS), mas que o usuário SUS adquire por via judicial, a fim de garantir seu direito citado na Constituição Brasileira (BRASIL, 2013).
Collis & Hussey (2005) afirmam que a pesquisa acadêmica pode ser classificada conforme seus objetivos e processos. O método qualitativo, por entender que uma análise mais reflexiva sobre o assunto pode ser fonte de fundamental entendimento de uma atividade socioeconômica (SILVERMAN, 2006). Para a análise, optou-se pela análise de conteúdo, definido como um conjunto de técnicas de análise das comunicações que possibilita chegar a conclusões lógicas e justificadas a partir do conteúdo das mensagens do emissor. A análise de conteúdo permite ao pesquisador estabelecer um conjunto de categorias e, posteriormente, analisar a sua frequência (SILVERMAN, 2006). De acordo com Martins & Theóphilo (2009), vários são os usos da análise de conteúdo, inclusive desvendar as ideologias dos dispositivos legais, foco deste trabalho.
O método de coleta de dados foi realizado por meio da análise de textos, licitações de medicamentos por ação judicial, portarias e publicações oficiais (Diário Oficial da União) do sistema de inclusão/atualização de medicamentos de alto custo na lista CEAF no Brasil e analisar as solicitações jurídicas de tratamento aos doentes que solicitam apoio ao Ministério Público, por falta de inclusão nas listas estaduais no sistema público.
Também foi realizada uma pesquisa documental e análise de conteúdo das listas publicadas no site da ANVISA sobre o registro dos medicamentos de alto custo mais citados em ações judiciais no período de 2012 a 2014, um total de 127 documentos relacionados ao tema, distribuídos por seis estados brasileiros: São Paulo, Minas Gerais, Bahia, Ceará, Paraná e Rio Grande do Sul. Como busca os descritores empregados foram: medicamento excepcional, medicamento de alto custo, ação judicial, SUS.
Ao analisar as informações referentes aos medicamentos de alto custo disponíveis nas publicações do Diário Oficial da União (DOU), observamos dez medicamentos de alto custo estão na condição de aprovados na lista de registro da ANVISA, porém não estavam disponíveis nas listas de medicamentos excepcionais para os Estados (Quadro 3). No caso do medicamento Lenalidomida, este não se encontrava incluído na lista CEAF e nem possui o registro da ANVISA, autorizando sua comercialização em território nacional, entretanto, a demanda de solicitação judicial no Brasil tem sido notada e, por vezes autorizada, face à sua relevância do tratamento oncológico preconizado.
Quadro 3. Medicamentos mais citados em solicitações judiciais de 2010 a 2014.
Nome comercial/ composição |
Indicação terapêutica |
Inclusão na lista CMDE |
Registro MS/ ANVISA |
Tarceva/ cloridrato de Erlotinib |
Antineoplásico |
Não incluso |
Sim: nº 1.0100.0651 |
Velcade/ Bortezomibe |
Antineoplásico |
Não incluso |
Sim: nº 1123633730018 |
Erbitux/ Cetuximabe |
Antineoplásico |
Não incluso |
Sim: nº 1.0089.0335 |
Mabthera/ Rituximab |
Antineoplásico |
Não incluso |
Sim: nº 101000548 |
Temodal/ Temozolomida |
Antineoplásico |
Não incluso |
Sim: nº 1.6614.0009 |
Avastin/ Bevacizumabe |
Antineoplásico |
Não incluso |
Sim: nº 1010006370023 |
Nexavar/ Tosilato de sorafenibe |
Antineoplásico |
Não incluso |
Sim: nº 1705600290061 |
Sutent/ Malato de sunitinibe |
Antineoplásico |
Não incluso |
Sim: nº 1.0216.0205 |
Herceptin/ Trastuzumab |
Antineoplásico |
Não incluso |
Sim: nº 101000552 |
Revlimid/ Lenalidomida |
Antineoplásico |
Não incluso |
Não há |
Fonte: Elaborado pelos autores
Diante da grande complexidade dos tratamentos oncológicos e da dificuldade de desenvolvimento de medicamentos antineoplásicos no Brasil, grande parte desses fármacos provêm de outros países, especialmente dos Estados Unidos, devido ao seu elevado grau de avanço tecnológico. Ocorre que o ingresso desses medicamentos no Brasil enfrenta muitas barreiras, com destaque para aquelas impostas pela ANVISA, o que acabam impedindo o registro de vários antineoplásicos que já se encontram disponíveis em aproximadamente 100 outros países. Como resultado, milhares de pacientes não têm acesso aos medicamentos que podem ser sua única chance de sobrevivência, perante as doenças cancerosas (PISCOPO et al., 2013).
A Lenalidomida (antineoplásico empregado em casos de mieloma múltiplo) não é disponível pelo SUS e tem alto custo de aproximadamente R$ 16,5 mil (uma caixa com 30 comprimidos). Mesmo para aqueles pacientes que poderiam custear o antineoplásico é necessário seguir a via judicial, pois no Brasil esse medicamento não foi aprovado pela ANVISA, ou seja, enquanto se discute ainda a aprovação da Lenalidomida no país, nos Estados Unidos uma nova droga de última geração derivada desta, a Pomalidomida, foi aprovada recentemente, em 08 de fevereiro de 2013 para o tratamento de mieloma múltiplo, mas ainda se emprega a Talidomida no Brasil, devido ao seu baixo custo (PISCOPO, 2013).
O Food and Drug Administration (FDA) concedeu a aprovação rápida do Pomalyst para pacientes com mieloma múltiplo que tenham recebido ao menos duas terapias prévias, incluindo Lenalidomida e Bortezomibe e que, tenham demonstrado progressão da doença dentro de 60 dias do término da última terapia (FDA, 2013).
Uma das razões para que o fornecimento de medicamentos sofra um atraso na demanda ou inclusão da lista brasileira é que esta depende dos critérios de diagnóstico, indicação e tratamento, inclusão e exclusão de pacientes, esquemas terapêuticos, monitoramento, acompanhamento e demais parâmetros contidos nos Protocolos Clínicos e Diretrizes Terapêuticas (PCDTs), estabelecidos pelo Ministério da Saúde na Portaria nº 2577 (BRASIL, 2006), para os medicamentos de dispensação excepcional, de abrangência nacional.
Outro ponto em que a morosidade dos trâmites leva o usuário SUS a buscar a via judicial são as atualizações dos PCDTs, que são publicadas em consulta pública pelo MS devem ser observadas pela Secretaria Estadual de Saúde (SES) e pelo Distrito Federal, na regulação da dispensação dos medicamentos. Os medicamentos integrantes do CMDE cujo PCDT não tenha ainda sido estabelecido em caráter nacional pelo MS ou publicado em consulta pública, deverão ser dispensados de acordo com critérios técnicos definidos pela SES e do Distrito Federal, até a edição do respectivo protocolo nacional (BRASIL, 2006).
Neste ponto surge a tensão entre o administrador e o especialista médico (aquele que domina o conhecimento para produzir o trabalho), considerando a necessidade imperiosa de hierarquia e controle (princípio fundamental da administração) segundo Bastos e Seidel (1992). O conflito entre administrador e médico (especialista) deflagra a ignição para a busca do direito constitucional do usuário, sendo a receita do medicamento de alto custo, a prova necessária para o processo judicial.
Segundo Farias e Vaitsman (2002) a autonomia dos médicos baseia-se no monopólio legítimo de um tipo de conhecimento específico que caracteriza seu campo de trabalho. Em razão disso, nenhum outro grupo da organização pode legitimamente exercer controle ou ingerência sobre sua atuação profissional. Mesmo entre os pares, a possibilidade de controle ou interferência é bastante limitada, uma vez que a autonomia na condução dos casos é resguardada pelos preceitos éticos, corporativos e culturais, próprios da profissão. Isso leva o médico a prescrever um tratamento adequado ao paciente, independente de onde virão os recursos para tal.
Das objeções encontradas nos documentos de 65 ações judiciais analisados, observamos que a resposta predominante dos gestores às demandas judiciais, para justificar o não fornecimento de medicamentos, é a não inclusão na lista CMDE, a exemplo do caso da droga Sorafenibe (Quadro 4):
Quadro 4. Posição dos atores na ação judicial de Sorafebine com base na ação civil do Ministério Público Federal (2008).
Posição do médico (especialista) |
O medicamento vem demonstrando resultados positivos no controle de tumores de fígado em estado avançado, além de melhores taxas de sobrevida e maior tempo livre de progressão da doença, em situações em que não há outra opção de tratamento. |
Posição do gestor estadual |
Sorafenibe 400 mg não faz parte do elenco de medicamentos de dispensação excepcional.Portanto, como este órgão só atende aos itens do elenco de Medicamentos e Dispensação Excepcional listados na referida portaria, fica inviabilizado o atendimento. |
Posição do Ministério Público Federal |
O direito público subjetivo à saúde representa prerrogativa jurídica indisponível assegurada à generalidade das pessoas pela própria Constituição da República (art. 196). Traduz bem jurídico constitucionalmente tutelado, por cuja integridade deve velar, de maneira responsável, o Poder Público, a quem incumbe formular - e implementar - políticas sociais e econômicas que visem a garantir, aos cidadãos, o acesso universal e igualitário à assistência médico-hospitalar. |
Fonte: Elaborado pelos autores
Nota-se que a falha no entendimento da gestão da lista CMDE, principalmente entre o médico especialista e o gestor público, gerou a incorporação de um novo elemento como stakeholder nesta cadeia, o Ministério Público (MP), a fim de restabelecer as relações entre ANVISA, MS, gestor, médico e usuário SUS, caracterizando a judicialização como fator determinante na aquisição de medicamentos de alto custo. A participação do MP nesta engrenagem de dispensação de medicamentos se dá pelo cumprimento da lei no Brasil. Na Constituição de 1988, o MP está incluído nas funções essenciais à justiça e não possui vinculação funcional a qualquer dos poderes do Estado (CNMP, 2012; BRASIL, 2013). O MP atua também na defesa dos interesses sociais e individuais indisponíveis e no controle externo da atividade policial e, pelo que se analisa, está cada vez mais integrado como ator na gestão da dispensação da lista de medicamentos de alto custo.
Os valores gastos pelo Ministério da Saúde para cumprir decisões judiciais que determinavam o fornecimento de medicamentos de alto custo aumentaram mais de 5.000% nos últimos seis anos. Foram gastos R$ 2,24 milhões em 2005 contra R$ 132,58 milhões em 2010. No ano passado, a União foi citada em cerca de 3,4 mil ações judiciais em busca de medicamentos. Em 2009 foram pelo menos 3,2 mil processos do gênero (FENAFAR, 2014). Na maioria dos casos, a Justiça determinou a entrega de medicamentos de alto custo - usados especialmente no tratamento oncológico ou de doenças raras. Quem decide entrar com uma ação para receber um remédio pode acionar qualquer esfera de governo: municipal, estadual ou federal.
Como as prefeituras têm menos recursos, em geral, os advogados processam o Estado onde reside o paciente. As ações contra a União são mais raras porque tendem a ser mais demoradas. O governo de São Paulo gasta cerca de R$ 57 milhões por mês para atender cerca de 25 mil ações judiciais ou processos administrativos relacionados à saúde, que estão em andamento. Ministério da Saúde atualizada a lista do SUS a cada dois anos e contempla vários medicamentos que possuem ações similares àqueles pedidos judicialmente (FENAFAR, 2014). Porém esse tempo é muito longo para quem está na espera de uma terapia antineoplásica, sofrendo de dor crônica ou com risco de morte, por exemplo.
Segundo a FENAFAR (2014) o professor de medicina baseada em evidências da Unifesp, Álvaro Nagib Atallah, concorda que há remédios que possuem evidência de que funcionam e não são implementados na rede SUS. Mas, diz ele, por outro lado, há muita medicação de alto custo demandada pela Justiça e nem sempre existem evidências.
Segunso Cambricoli (2015) o número de pacientes que entraram na Justiça contra o SUS na capital paulista cresceu 32% em três anos, segundo dados obtidos pelo Estado com o Tribunal de Justiça de São Paulo (TJ-SP). Em 2010, foram ajuizadas 1.514 ações nas varas da cidade de São Paulo responsáveis por receber pedidos de procedimentos médico-hospitalares ou remédios.
Em 2013, o número de processos do tipo passou para 2.011, uma média de uma nova ação a cada quatro horas. Estão incluídos nesses números pedidos de remédios ou terapias ainda não disponíveis no Brasil ou na rede pública. Os órgãos acionados no âmbito estadual são as secretarias da saúde do Município ou do Estado e só no ano de 2014, a Secretaria Municipal da Saúde gastou R$ 3,2 milhões com demandas judiciais, 20% a mais do que em 2010, quando o custo com ações foi de R$ 2,6 milhões (CAMBRICOLI, 2015).
O ponto crítico encontra-se no fluxo de aprovação de novas drogas de custo elevado e a disponibilidade ao usuário SUS está entre a aprovação da droga pela ANVISA no Brasil e a não atualização das listas de distribuição de medicamentos pelo Ministério da Saúde para o SUS, conforme demonstram as Figuras 2 e 3.
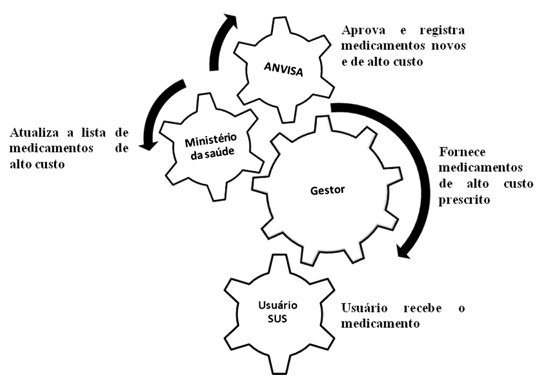
Figura 2. Fluxo da disponibilização de medicamentos de alto custo (ideal).
Fonte: Elaborado pelos autores
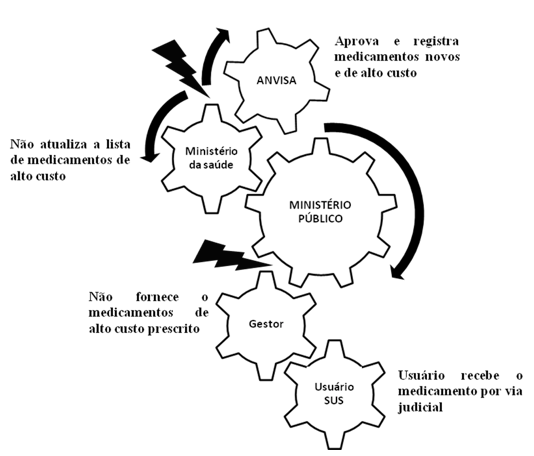
Figura 3. Fluxo da disponibilização de medicamentos de alto custo (por via judicial).
Fonte: Elaborado pelos autores
Segundo Cárias e colaboradores (2001) o Programa MDCE apresentou mudanças significativas em seus aspectos técnicos e administrativos. O programa, pensado inicialmente para atender a parcela pequena e específica da população, acometida por doenças consideradas de caráter excepcional, esbarrou na evolução técnico-científica mundial ocorrida ao longo desses anos e transformou-se em porta de entrada dos novos medicamentos desenvolvidos para tratamento de doenças que, até então, não tinham cobertura pelo SUS. Isso pode ser observado por meio do número de fármacos (distribuídos pelo Programa) que aumentou aproximadamente oito vezes em nove anos. Agora não apenas escolher qual o melhor tratamento em função do custo, mas quem receberá o tratamento, mediante a grande demanda de pacientes que necessitam de medicamentos excepcionais ou de alto custo.
No entanto, como toda nova tecnologia, os novos medicamentos chegam ao mercado com preços elevados e as inclusões no Programa tiveram grande impacto nos gastos do Ministério da Saúde. Nesse sentido, há uma questão de grande importância a ser discutida e avaliada pelos gestores e pela equipe técnica: dentro de uma classe terapêutica, destinada para o tratamento de uma mesma doença, optar por qual medicamento será fornecido. Considerando os princípios de saúde pública de garantir o melhor atendimento para a maioria da população e considerando que os recursos destinados a esse fim são finitos, a avaliação bastante detalhada torna-se cada vez mais necessária (CÁRIAS, 2001).
No Brasil, o processo de reforma do Estado iniciado na década de 90 tem tentado promover maior flexibilidade na administração pública mediante a implementação de um modelo gerencial em substituição ao tradicional modelo burocrático. O ideário da reforma abre a perspectiva de maior autonomia gerencial para as organizações públicas, que passariam a ser controladas por seus resultados, em vez do rígido controle sobre os processos (FARIAS & VAITSMAN, 2002).
Novas tendências de ações já foram observadas em alguns estados brasileiros e, a exemplo de tal fato, em 26 de setembro de 2012, o Conselho Nacional de Secretários da Saúde (CONASS) informou em nota técnica, a todas as coordenações de Assistência Farmacêutica das Secretarias Estaduais de Saúde, a decisão de incorporação do Trastuzumabe no SUS, para tratamento de câncer de mama. Isso gerou um novo índice de ajuste de preços na lista CDME, devido à demanda judicial, conforme apontado no Quadro 5:
Quadro 5. Valor do medicamento Trastuzumabe de acordo com determinação judicial.
Apresentação |
Preço fábrica |
PMVG* (Preço Máximo de Venda ao Governo) |
Trastuzumabe (Herceptin®) 440mg |
R$ 9.317,81
|
Somente aplicado para aquisições feitas por determinação judicial (PF – CAP-ICMS). |
Fonte: Dados do Conselho Nacional de Secretários da Saúde (2013).
A betagalsidase foi aprovada, em 2003, pelo FDA e pela European Medicines Agency (EMEA), para o tratamento da doença de Fabry e que incluiu 58 pacientes (Eng et al., 2001). Este fármaco já possui registro na ANVISA, é de alto custo, mas não faz parte da lista de medicamentos excepcionais do Ministério da Saúde, conforme já apontado por Souza (2010).
A doença de Gaucher é outro exemplo de tratamento (de alto custo), cuja demanda é cada vez maior, balizada por ordens judiciais que entram em conflito com a Política Nacional de Medicamentos (Souza, 2010). Exemplos como o da doença de Gaucher explicam o aumento da intervenção do Poder Judiciário e da quantidade de liminares concedidas em sede de ações civis públicas, em mandados de segurança, entre outros, pode, eventualmente, induzir o gestor de saúde a uma espécie de inércia em relação às providências que lhe competem legal e constitucionalmente.
Tem-se observado o fato de que, com base na demanda da população usuária, profissionais da área médica e/ou segmentos dos próprios gestores de saúde encaminham o paciente/usuário ao Ministério Público para que a ação ou o serviço de saúde sejam pleiteados por meio de requisição ministerial ou de provimento jurisdicional. O artifício utilizado pode culminar fomentando atitudes do poder público em não desempenhar suas atribuições naturalmente, permanecendo no aguardo de postulação do Ministério Público ou de determinação do Poder Judiciário, com prejuízos evidentes ao planejamento e à racionalidade do Sistema Único de Saúde (Dantas & Silva, 2006).
O gestor público deve acompanhar as discussões sobre o entrave na disponibilização de medicamentos de alto custo, uma vez que as novas tendências terapêuticas provavelmente serão incorporadas ao SUS nos próximos anos. Como exemplo dessa afirmativa, existe a perspectiva de que os tratamentos com medicamentos de alto custo sejam incorporados ao SUS nos próximos dez anos, para as doenças aqui citadas como Doença de Fabry e Doença de Gaucher e, talvez fosse importante a adoção pelo governo brasileiro de medidas para o desenvolvimento de mecanismos que propiciassem a realização de ensaios clínicos nessa área, coordenados e subsidiados pelo governo, o que não ocorre como política prioritária no Brasil.
Certamente é o governo que vai arcar com os custos de tais tratamentos (pois todos serão necessariamente de alto custo) e os ensaios clínicos poderiam ser desenhados conforme a sua demanda, comparando, por exemplo, as diversas formas de tratamento, inclusive combinados, ressaltando que na Inglaterra e EUA, os tratamentos para a doença de Fabry custa por paciente/ano em torno de 200 a 300 mil dólares (Souza, 2010).
Alguns países tentaram definir esse tipo de medicamento, principalmente por meio de indicadores qualitativos (medicamentos para doenças com alto risco à vida, por exemplo) e quantitativos (fixando uma quantia como referência por paciente, ano ou tratamento) (OPAS, 2009).
Como comparação, o Brasil prioriza o financiamento pelo tipo de medicamento, sem um estudo específico por patologia, mas sim pela demanda e regionalização dos principais pólos ou centros de referência terapêutica, como exemplo da Portaria nº 2.592, de 27 de outubro de 2006, que registrou os valores destinados ao financiamento de medicamentos excepcionais quanto aos meses de outubro, novembro e dezembro de 2006. As quantias variaram nestes 3 meses de R$ 215 mil (repassados ao Acre) a R$ 49 milhões (repassados a São Paulo), num total de cerca de R$ 115 milhões (Portaria nº 2.592, 2006). Faz necessário analisar as novas demandas de gastos de patologias consideradas raras ou de tratamento que requer custos elevados, a exemplo da Inglaterra e EUA.
De acordo com Rahim, Magner e Shapiro (2000), a gestão construtiva dos conflitos numa organização é fundamental para que essa organização esteja mais capacitada em enfrentar os desafios atuais e futuros. É imprescindível, como estratégia futura no Brasil, a proximidade com a indústria farmacêutica e a formação de uma equipe heterogênea, composta por representantes como gestores públicos, médicos, pacientes, representantes da indústria farmacêutica e do próprio ministério público.
Freeman (1984) destacou que a organização que não entende quem são seus stakeholders, não possui processos padronizados para se relacionar com seus interesses e que não tem um conjunto de transações para negociar com seus stakeholders, supostamente, terá uma menor, ou inferior, capacidade de geri-los. O autor ainda ressalta que alguns membros de um grupo de stakeholders podem ser membros de outros grupos, e na qualidade de stakeholder em uma organização, deve equilibrar (ou não) conflitos e competições de papéis.
Schiavoni et al., 2013 apontaram que qualquer ferramenta que busca um incremento na capacidade de gestão dos stakeholders de uma organização deve iniciar a aplicação a partir da definição básica. Quem são os grupos ou indivíduos afetados ou que afetam o alcance dos objetivos da organização?
Uma forma de se ser mais competitivo é através da utilização de equipes heterogêneas, com uma composição cross-functional, isto é, compostas de membros com funções diferentes. O pressuposto destes grupos cross-funcionais é que pessoas com perspectivas e funções diferentes poderão oferecer soluções inovadoras para os vários problemas que se colocam. O desafio destes grupos é o de gerir bem o conflito que, inevitavelmente, surgirá no seio do grupo devido à existência de diferentes perspectivas (McINTYRE, 2007).
O bom funcionamento dessas equipes heterogêneas tem sido uma tarefa difícil, particularmente na resolução de tarefas mais complexas. A eficácia de uma equipe não depende apenas do desempenho individual dos seus elementos, mas igualmente da estreita colaboração entre os membros, do grau de entre ajuda existente, da capacidade dessa equipe para tolerar pontos de vista divergentes, isto é, o conflito (McINTYRE, 2007).
Como resposta à questão de pesquisa inicial e dentre os desafios do gestor público, que deflagram a judicialização na aquisição de medicamentos de alto custo pelo usuário do SUS, a demora na aprovação de novas drogas antineoplásicas pela ANVISA, adequação lenta dos protocolos clínicos e inclusão de medicamentos da lista CEAF, agregou o Ministério Público como elo funcional nestas relações de conflitos.
A adoção de novas estratégias depende da resolução dos conflitos analisados, mas que deve envolver tanto a indústria farmacêutica, interessada na comercialização dos seus medicamentos, como o grupo (muitas vezes pequeno, mas não menos importante) dos portadores de doenças raras e/ou usuários de medicamentos de alto custo. É importante saber quem são, onde estão e quais as necessidades destes indivíduos para funcionar a engrenagem na gestão da lista CEAF, sem que a judicialização seja, na prática, um componente essencial.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA (ANVISA). Medicamentos de Dispensação em Caráter Excepcional, 2013. Disponível em: http://www.anvisa.gov.br/medicamentos/glossario/glossario_m.htm. Acesso em: 08 julho 2014.
BASTOS, Antonio Virgílio Bittencourt; SEIDEL, Thereza Toffano. O conflito nas organizações: a trajetória de sua abordagem pelas teorias organizacionais. Revista de Administração, São Paulo, v. 27, n. 3, p. 48-60, julho/setembro, 1992.
BLAU, Peter. M.; SCOOT, W. Richard. Dilemmas of formal organization. In.: ETZIONI, A. Readings on modern organizations. Englewood Cliffs, New Jersey: Prentice Hall, 1969. p. 130-147.
BRASIL. Lei nº 8080, de 19 de setembro de 1990. Dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes e dá outras providências. Diário Oficial [da] República Federativa do Brasil, Poder Executivo, Brasília, DF, 20 set. 1990. Seção 1, p. 18055.
BRASIL, Constituição da República Federativa do Brasil de 1988. Série Legislação Brasileira. Editora Saraiva. 2013.
BRASIL. Ministério Público Federal. Ação Civil Pública. Pedido de Antecipação dos Efeitos da Tutela - Tosilato De Sorafenibe, Nexavar 400 mg, 2008. Disponível em: http// www.saude.caop.mp.pr.gov.br/arquivos/File/peticoes/.../medic158.doc. Acesso em: 30 ago. 2015.
BRASIL. Portaria GM/MS nº 2.577, de 27 de outubro de 2006. Aprova o componente de medicamentos de dispensação excepcional. Brasília, DF: Gabinete do Ministro/ Ministério da Saúde. Disponível em:. http://dtr2001.saude.gov.br/sas/PORTARIAS/Port2006/GM/GM-2577.htm. Acesso em: 13 nov. 2015.
BRASIL. Portaria GM/MS nº 3916, de 30 de outubro de 1998. Aprova a Política Nacional de Medicamentos. Brasília, DF: Gabinete do Ministro/ Ministério da Saúde. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/gm/1998/prt3916_30_10_1998.html. Acesso em: 16 junh. 2015.
BRASIL. Portaria nº 2.592, de 27 de outubro de 2006. Define os recursos que serão repassados aos estados e ao Distrito Federal, a título de co‑financiamento, para aquisição e distribuição de Medicamentos Excepcionais constantes do Grupo 36 - Medicamentos da Tabela Descritiva do Sistema de Informações Ambulatoriais do Sistema Único de Saúde (SIA/SUS). Brasília, DF: Gabinete do Ministro/ Ministério da Saúde. Disponível em: http://dtr2001.saude.gov.br/sas/PORTARIAS/Port2006/GM/GM-2592.htm. Acesso em: 16 jan. 2016.
CAMBRICOLI, Fabiana. SP: ações judiciais por tratamentos e medicamentos sobem 32% em 3 anos. 2015. O estadão. Disponível em: http://saude.estadao.com.br/noticias/geral,acoes-na-justica-de-sp-por-tratamentos-e-medicamentos-sobem-32-em-3-anos,1618519. Acesso em: 16 jan. 2016.
CARIAS, Claudia Mezleveckas; VIEIRA, Fabíola Sulpino; GIORDANO, Carlos V; ZUCCHI, Paola. Medicamentos de dispensação excepcional: histórico e gastos do Ministério da Saúde do Brasil. Revista de Saúde Pública, v. 45, n. 2, p. 233-240, 2011.
COLLIS, Jill; HUSSEY, Roger. Pesquisa em administração: um guia prático para alunos de graduação e pós-graduação. 2. ed. Porto Alegre: Bookman, 2005.
CONSELHO NACIONAL DE SECRETÁRIOS DA SAÚDE. Considerações sobre o medicamento Trastuzumabe. Incorporado no SUS para tratamento de câncer de mama HER2 positivo, em fase inicial ou localmente avançado. Nota Técnica CONASS, nº 19, 2013. Disponível em: http://www.conass.org.br/Notas%20t%C3%A9cnicas%202013/NT%2019%20-%202013%20-%20%20Trastuzumabe.pdf. Acesso em: 03 julho 2014.
CONSELHO NACIONAL DO MINISTÉRIO PÚBLICO. Funções do MP (2012). Disponível em: http://www.cnmp.mp.br/portal/component/content/article/94-institucional/ministerio-publico/130-funcoes-do-mp. Acesso em: 16 jul. 2015.
COSTELLOE, Céire; METCALFE,Chris; LOVERING, Andrew,MANT, David; HAY, Alastair D. Effect of antibiotic prescribing in primary care on antimicrobial resistance in individual patients: systematic review and meta-analysis. British Medical Journal, v. 340, p. c2096, 2010.
DANTAS, Nara Soares; SILVA, Ramiro Rockenbach. Medicamentos excepcionais. Manuais de Atuação da Escola Superior do Ministério Público da União. Brasília, 2006. 90 p.
FARIAS, Luis Otávio Pires; VAITSMAN, Jeni. Interação e conflito entre categorias profissionais em organizações hospitalares públicas. Cadernos de Saúde Pública, Rio de Janeiro, v.18, n.5, p. 1229-1241, set-out, 2002.
FEDERAÇÃO NACIONAL DOS FARMACÊUTICOS. Gasto do governo com remédios via ação judicial cresce 5.000% em 6 anos. Disponível em: http://www.fenafar.org.br/portal/sus/64-sus/927-gasto-do-governo-com-remedios-via-acao-judicial-cresce-5000-em-6-anos.html. Acesso 10 junho 2015.
FOOD AND DRUG ADMINISTRATION. How to Apply for Designation as an Orphan Product. For Industry. 2013. Disponível em: http://www.fda.gov/orphan/index.htm. Acesso 02 agosto 2015.
FREEMAN, R. Edward. Strategic management: a stakeholder approach. Boston: Pitman, 1984.
GANDINI, João Agnaldo Donizeti; BARIONE, Samantha Ferreira; SOUZA, André Evangelista de. A judicialização do direito à saúde: a obtenção de atendimento médico, medicamentos e insumos terapêuticos por via judicial: critérios e experiências. Brasília, DF: Biblioteca Digital Jurídica, 2007. Disponível em: <http://bdjur.stj.jus.br/dspace/handle/2011/16694>. Acesso em: 05 mar. 2016.
HABERLE, Peter. Hermenêutica constitucional: a sociedade aberta dos interpretes da Constituição. Contribuição para a interpretacao pluralista e "procedimental" da Constituição. Porto Alegre: S. A. Fabris, 1997.
MARTINS, Gilberto de Andrade; THEÓPHILO, Carlos Renato. Metodologia da investigação científica para Ciências Sociais Aplicadas. São Paulo: Atlas, 2009.
McINTYRE, Scott Elmes. Como as pessoas gerem o conflito nas organizações: Estratégias individuais negociais. Análise Psicológica, v. 2, n. 25, p. 295-305, 2007.
ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. O acesso aos medicamentos de alto custo nas Américas: contexto, desafios e perspectivas. Brasília: Série Técnica No 1: Medicamentos Essenciais, Acesso e Inovação (THR/EM). Washington, DC, 20037. Outubro, 2009, 78 p.
MINISTÉRIO DA SAÚDE. Protocolos Clínicos e Diretrizes Terapêuticas - Medicamentos Excepcionais. Vol. 1. Série A. Normas e Manuais Técnicos. Porto Alegre: GráficaPallotti, 2010.
PISCOPO, Marcos Roberto; AQUINO, Simone; NOVARETTI, Marcia Cristina Zago (2013). Medicamentos Antineoplásicos e a ANVISA: O Caso Lenalidomida. Revista de Administração Hospitalar, v.10, n. 3, p. 44-60, 2013.
SÃO PAULO (Estado). Secretaria Estadual da Saúde. Relação de Medicamentos de Alto Custo (Dispensação Excepcional), 2013. Disponível em: http://www.saude.sp.gov.br/content/geral_acoes_assitencia_farmaceutica_orientacoes_para_obtencao_de_medicamento_do_componente_especializado.mmp. Acesso em: 12 ago. 2015.
SCHIAVONI, Patrícia Mattos de Barros; MORAES, Mário César Barreto; CASTRO, Alice Carneiro; SANTOS, Jair Nascimento. Stakeholders: principais abordagens. Revista de Ciências da Administração, v. 15, n. 37, p. 187-197, 2013.
SILVA, Regina Célia dos Santos. Medicamentos excepcionais no âmbito da assistência farmacêutica no Brasil.2000. Dissertação (Mestrado em Saúde Pública) -Escola Nacional de Saúde Pública SergioArouca - Fundação Oswaldo Cruz, Riode Janeiro.
SILVERMAN, David. Interpreting Qualitative Data: Methods for Analyzing Talk, Text and Interaction Paperback . Sage Publications: London, 2006.
SOUZA, Mônica Vinhas; KRUG, Bárbara Corrêa; PICON, Paulo Dornelles; SCHWARTZ, Ida Vanessa Doederlein. Medicamentos de alto custo para doenças raras no Brasil: o exemplo das doenças lisossômicas. Revisão. Ciência e Saúde Coletiva, v. 15, supl. 3, p. 3443-3454, 2010.
1. Professora Doutora da Universidade Nove de Julho-UNINOVE pelo Programa de Mestrado Profissional em Administração - Gestão em Sistemas de Saúde da UNINOVE, professora do curso de graduação de Farmácia Bioquímica - UNINOVE e Editora Adjunta da Revista de Gestão em Sistemas de Saúde-UNINOVE. E-mail: siaq66@uninove.br ¤ siaq06@hotmail.com
2. Professor Doutor da Universidade Nove de Julho-UNINOVE pelo Programa de Pós-Graduação em Administração (PPGA) e do Programa de Mestrado Profissional em Administração - Gestão de Projetos (PMPA-GP) - UNINOVE. Professor do Departamento de Administração Geral e Recursos Humanos na EAESP/FGV. Editor Chefe da Revista de Gestão e Projetos (GeP) e Membro do Conselho Editorial do Iberoamerican Journal of Project Management (IJoPM). E-mail: piscopomr@gmail.com